Курсовая работа: Применение ЭВМ в технологии лекарственных препаратов
Связь называется ковалентной (гомеополярной), если образующие ее атомы обладают близким сродством к электрону. В этом случае не происходит преимущественной передачи электрона какому-либо атому. Обычно ковалентная связь образуется за счет обобществления электронов, ранее принадлежавших двум отдельным атомам.
Природа ковалентной связи значительно сложнее, чем ионной, и объясняется лишь на основе квантовой механики, причем строго количественное исследование возможно пока что для простейших молекул (Н2 , Н2 + и некоторых других). Для сложных соединений решение уравнения Шредингера производится с помощью приближенных методов, дающих чаще всего только качественные результаты.
К наиболее распространенным методам квантовой химии относятся метод валентных связей (электронных пар) и метод молекулярных орбиталей (МО). Конечная цель обоих методов – нахождение энергии и получение из одноэлектронных атомных волновых функций приближенных волновых функций молекул. Значения Е и ψ должны быть такими, чтобы после подстановки уравнение Шредингера превращалось в тождество. Эти методы в ходе математических расчетов широко отражаются на данные физико-химических исследований свойств молекул.
Метод валентных связей (ВС) разработан Гейтлером и Лондоном (1927) при изучении строения молекулы водорода. Метод основан на предположении, что химическая связь образуется парой электронов в процессе сближения и взаимодействия атомов. Молекулу водорода можно изобразить тремя валентными структурами На – Нb , На - – Нb + и На + – Нb - с различным расположением (смещением) электронной пары. Взаимодействие ядер а и b и электронов 1 и 2 схематически изображено на рис 1. Так как волновая функция ψ зависит от координат двух электронов, то уравнение Шредингера для такой молекулярной системы принимает вид:
![]() , (10)
, (10)
где ![]() и
и ![]() - операторы Лапласа по координатам (χ1 , y1 , z1 ,) первого электрона и координатам (χ2 , y2 , z2 ,) второго электрона.
- операторы Лапласа по координатам (χ1 , y1 , z1 ,) первого электрона и координатам (χ2 , y2 , z2 ,) второго электрона.
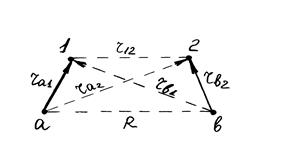
Рис. 1 Схема взаимодействий ядер и электронов в молекуле водорода.
С учетом всевозможных взаимодействий микрочастиц в молекуле Н2 потенциальная энергия находится из равенства:
![]() , (11)
, (11)
где первые два члена в скобках выражают соответственно энергии взаимного отталкивания ядер и электронов, остальные – энергии притяжения электронов к ядрам.
Точное нахождение волновой ψ-функции и минимума полной энергии с помощью уравнений (10) и (11) невозможно даже для такой простой двухэлектронной системы, как молекула Н2 , поэтому используется приближенный метод. Сначала оценивают волновую функцию и энергию изолированных атомов, а далее переходят к системе из связанных атомов.
Обозначим волновые функции двух изолированных атомов φа (1) и φb (2). Тогда волновая функция ψІ системы из двух несвязанных атомов выражается произведением ψІ = φа (1) ∙ φb (2).
Допустим, что атомы сблизились на расстояние, достаточное для образования химической связи, и что при этом функция ψІ не изменилась и близка к истинной. Однако в новом состоянии принадлежность каждого электрона к любому из ядер равновероятна, и можно записать, что
ψІІ = φа (2) ∙ φb (1). Тога ψ± - функция молекулы Н2 является линейной комбинацией двух атомных функций:
ψ± = с1 ψІ + с2 ψІІ , (12)
где с1 и с2 – некоторые постоянные.
Уравнение (12) является общим решением уравнения (10). Конкретное его решение состоит в нахождении значений с1 и с2 и далее по ψ± приближенного значения энергии Е± . Искомую ψ-функцию выбирают с помощью вариационного метода , которые дает
с1 = ± с2 и ψ± = ψІ + ψІІ .
Функция ψ+ = φа (1)∙φb (2) + φа (2)∙φb (1), не изменяющая знак при перестановке электронов, называется симметричной . Меняющая знак функция ψ- = φа (1)∙φb (2) – φа (2)∙φb (1), называется асимметричной.
Выражение для энергии, которая отвечает функции ψ± , имеет вид:
![]() , (13)
, (13)
Уравнение (13) показывает, как должно изменяться значение полной энергии для симметричной и асимметричной функции. Величины J, K и S обозначают три интеграла:
1) кулоновский интеграл J выражает энергию взаимодействия зарядов при отсутствии обмена электронов между ядрами:
![]() ,
,
где ![]() можно рассматривать как члены гамильтониана, выражающие взаимодействие между атомами;
можно рассматривать как члены гамильтониана, выражающие взаимодействие между атомами;
2) обменный интеграл К характеризует уменьшение энергии системы, связанное с обменом электронов местами:
![]() ;
;
3) интеграл перекрывания S отвечает перекрыванию волновых функций соединяющихся атомов: