Курсовая работа: Применение катализа для защиты окружающей среды
Этиловый спирт, получаемый ферментативным путем, широко используют в качестве автомобильного топлива. В Бразилии более трети из примерно 10 млн. автомобилей работают на 96%-ном этиловом спирте, получаемом из сахарного тростника, а остальные – на смеси бензина и этилового спирта (20%). Хорошо отработана технология производства топлива, представляющего собой смесь бензина и спирта, в США. В 1987 из зерен кукурузы было получено ок. 4 млрд. л спирта, из них примерно 3,2 млрд. л было использовано в качестве топлива. Разнообразное применение находят и т.н. иммобилизованные ферменты. Эти ферменты связаны с твердым носителем, например силикагелем, над которым пропускают реагенты. Преимущество этого метода состоит в том, что он обеспечивает эффективное контактирование субстратов с ферментом, разделение продуктов и сохранение фермента. Один из примеров промышленного использования иммобилизованных ферментов – изомеризация D-глюкозы во фруктозу.
Глава 2. Технологические аспекты применения катализаторов
Современные технологии невозможно представить без применения катализаторов. Каталитические реакции могут протекать при температурах до 650С и давлениях 100 атм и более. Это заставляет по-новому решать проблемы, связанные с контактированием между газообразными и твердыми веществами и с переносом частиц катализатора. Чтобы процесс был эффективным, при его моделировании необходимо учитывать кинетические, термодинамические и гидродинамические аспекты. Здесь широко используются компьютерное моделирование, а также новые приборы и методы контроля за технологическими процессами.
В 1960 был достигнут значительный прогресс в производстве аммиака. Применение более активного катализатора позволило понизить температуру получения водорода при разложении водяного пара, благодаря чему удалось понизить давление и, следовательно, уменьшить производственные затраты, например за счет применения более дешевых центробежных компрессоров. В результате стоимость аммиака упала более чем вдвое, произошло колоссальное увеличение его производства, а в связи с этим – увеличение производства пищевых продуктов, поскольку аммиак – ценное удобрение.
Каталитический метод . Этим методом превращают токсичные компоненты промышленных выбросов в вещества безвредные или менее вредные для окружающей среды путем введения в систему дополнительных веществ, называемых катализаторами. Каталитические методы основаны на взаимодействии удаляемых веществ с одним из компонентов, присутствующих в очищаемом газе, или со специально добавляемым в смесь веществом на твердых катализаторах. Действие катализаторов проявляется в промежуточном (поверхностном) химическом взаимодействии катализатора с реагирующими соединениями, в результате которого образуются промежуточные вещества и регенерированный катализатор.
Методы подбора катализаторов отличаются большим разнообразием, но все они базируются в основном на эмпирических или полуэмпирических способах. Об активности катализаторов судят по количеству продукта, получаемого с единицы объема катализатора, или по скорости каталитических процессов, при которых обеспечивается требуемая степень превращения.
Скорость каталитических процессов выражают общепринятым для всех химических реакций уравнением
ωk =kω Cа 1 Cb 2 ...,
где С1 С2 и т. д.- концентрации веществ, участвующих в реакции; kω - константа скорости реакции; a, b - порядок реакции по соответствующему компоненту.
Зависимость константы скорости реакции от температуры описывается законом Аррениуса: kω =ze-E/RT , где Т - абсолютная температура; R - газовая постоянная; Е - энергия активации; z - предэкспоненциальный множитель. Величины Е и z - постоянные, характерные для данной химической реакции и катализатора.
В большинстве случаев катализаторами могут быть металлы или их соединения (платина и металлы платинового ряда, оксиды меди и марганца и т. д.). Для осуществления каталитического процесса необходимы незначительные количества катализатора, расположенного таким образом, чтобы обеспечить максимальную поверхность контакта с газовым потоком. Катализаторы обычно выполняются в виде шаров, колец или проволоки, свитой в спираль. Катализатор может состоять из смеси неблагородных металлов с добавкой платины и палладия (сотые доли % к массе катализатора), нанесенных в виде активной пленки на нихромовую проволоку, свитую в спираль.
Объем катализаторной массы определяется исходя из максимальной скорости обезвреживания газа, которая в свою очередь зависит от природы и концентрации вредных веществ в отходящем газе, температуры и давления каталитического процесса и активности катализатора. Допустимая скорость обезвреживания находится в пределах 2000-60000 объемов газа на. объем каталитической массы в час. На катализаторах, разработанных в Дзержинском филиале НИИОГАЗа, при скорости обезвреживания 30000-60000 объемов обезвреживаемого газа на объем катализаторной массы в час и температуре 350-420°С практически полностью окисляются примеси этилена, пропилена, бутана, пропана, ацетальдегида, спиртов (метилового, этилового, пропилового, аллилового и др.), ацетона, этилацстона, бензола, толуола, ксилола, оксида углерода и др.
Существенное влияние на скорость и эффективность каталитического процесса оказывает температура газа. Для каждой реакции, протекающей в потоке газа, характерна так называемая минимальная температура начала реакции, ниже которой катализатор не проявляет активности. Температура начала реакции зависит от природы и концентрации улавливаемых вредностей, скорости потока и типа катализатора. С повышением температуры эффективность каталитического процесса увеличивается. Например, метан начинает окисляться на поверхности катализатора, состоящего из 60% диоксида марганца и 40% оксида меди, только при температуре 320°С, а 97%-ное реагирование наблюдается при t=450°С. Следует, однако, иметь в виду, что для каждого катализатора существует предельный температурный уровень. Повышение этого уровня приводит к снижению активности, а затем к разрушению катализатора.
Для поддержания необходимой температуры газа иногда к нему подмешивают (особенно в пусковой период) продукты сгорания от вспомогательной горелки, работающей на каком-либо высококалорийном топливе. На рис. 1 представлен каталитический реактор, предназначенный для окисления толуола, содержащегося в газовоздушных выбросах цехов окраски. Воздух, содержащий примеси толуола, подогревается в межтрубном пространстве теплообменника - рекуператора 1, откуда по переходным каналам он поступает в подогреватель 4. Продукты сгорания природного газа, сжигаемого в горелках 5, смешиваются с воздухом, повышая его температуру до 250-350°С, т. е. до уровня, обеспечивающего оптимальную скорость окисления толуола на поверхности катализатора. Процесс химического превращения происходит на поверхности катализатора 3, размещенного в контактном устройстве 2. В качестве катализатора применена природная марганцевая руда (пиромзит) в виде гранул размером 2-5 мм, промотированных азотнокислым палладием. В результате окисления толуола образуются нетоксичные продукты: оксид углерода и водяные пары (С7 Н8 +9О2 ->7СО2 +4Н2 О). Смесь воздуха и продуктов реакции при температуре 350-450°С направляется в рекуператор 1, где отдает тепло газовоздушному потоку, идущему на очистку, и затем через выходной патрубок выводится в атмосферу. Эффективность очистки такого реактора составляет 95-98% при расходе вспомогательного топлива (природного газа) 3,5-4,0 м3 на 1000 м3 очищаемого воздуха. Гидравлическое сопротивление реактора при номинальной нагрузке (800-900 м3 /ч) не превышает 150-180 Па. Скорость процесса находится в пределах от 8000 до 10000 объемов на объем катализаторной массы в 1 ч.
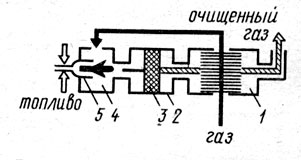
Рис. 1. Каталитический реактор
В последние годы каталитические методы очистки нашли применение для нейтрализации выхлопных газов автомобилей. Для комплексной очистки выхлопных газов - окисления продуктов неполного сгорания и восстановления оксида азота -применяют двухступенчатый каталитический нейтрализатор (рис. 2). Установка состоит из последовательно соединенных восстановительного 2 и окислительного 4 катализаторов. Отработавшие газы через патрубок 1 поступают к восстановительному катализатору 2, на котором происходит нейтрализация оксидов азота по следующим реакциям:
ТЩ+СО-Ю1.2Т2 +СЩ2 ж ТЩ+Н2 -Ю1.2Т2 +Н2 О
В качестве восстановительного катализатора применяют монельметалл (медноникелевый сплав) или катализатор из благородных металлов (например, платина на глиноземе). При объемной скорости порядка 100000 ч-1 эффективность очистки по NO достигает 90% и выше.
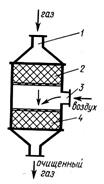
Рис. 2 Двухступенчатый каталитический нейтрализатор
После восстановительного катализатора к отработавшим газам для создания окислительной среды через патрубок 3 подводится вторичный воздух. На окислительном катализаторе происходит нейтрализация продуктов неполного сгорания - оксида углерода и углеводородов:
СО+1.2Щ2 -ЮСЩ2 ж Сч Рн +(ч+н.4)Щ2 -ЮчСЩ2 +1.2Р2 Щб
Для окислительных процессов применяют катализатор из благородных металлов или оксидов переходных металлов (медь, никель, хром и др.). Содержание оксида углерода в выхлопных газах автомобиля с нейтрализатором снижается почти в 10 раз, а углеводородов - ~ в 8 раз. Широкому применению каталитических нейтрализаторов препятствуют использование этилированного бензина, который содержит определенное количество свинца. Свинец дезактивирует катализаторы в течение 100-200 ч.
Для расчета каталитического реактора необходимы следующие параметры: объемный расход очищаемого газа Qг , м3 /с; состав и концентрация примесей Св , мг/м3 ; тип катализатора; скорость обезвреживания газа ωк , 1/ч, и рекомендуемая температура перед слоем катализатора ТК. Минимальный объем Vк , м3 , катализаторной массы определяют исходя из максимальной скорости обезвреживания газа Vк = Qг /ωк . Толщина слоя катализатора h, м, необходимая для достижения заданной степени очистки η, определяется по формуле
р=Т0 ωр .(Ыэф β)б
где Т0 =дт 1.1-η – число единиц переноса;
ωp =ω0 -Tp /T0 1/Пк - скорость газа при рабочих условиях, м/с;
ω0 - линейная скорость потока газа при нормальных условиях (T0 =273К и Р=101,3 кПа), отнесенная к полной фильтрующей поверхности (на практике обычно применяют