Курсовая работа: Применение органических реагентов в аналитической химии
Дитизон используется также для определения Cu(II), Ag(I), Au(III), Cd(II), Hg(II), In(III), Tl(I), Pb(II), Bi(III), Co(II), Ni(II), Pd(II), Pt(II) и некоторых других ионов.
Как лиганд дитизон может выступать в форме анионов НDzˉ и НDz2- , образуя комплексы состава Cd(НDz)2 , Ag2 Dz, Pb(НDz)2 , PbDz, PdDz и так далее.
Диметилглиоксим (диацетилдиоксим, реактив Чугаева)

Это – классический органический реагент, впервые предложенный, как уже отмечалось, Л.А. Чугаевым в 1905 году в качестве специфического селективного реагента на никель.
Ионы Ni2+ образуют с диметилглиоксимом в водной среде объёмистый осадок красного цвета, малорастворимый в воде и в водном аммиаке, но растворимый в минеральных кислотах. Реакция протекает по схеме:
Ni2+ + HDMG→ [Ni(DMG)2 ] + 2Н+
где HDMG – сокращённое обозначение молекулы диметилглиоксима. Структурная формула образующего комплекса будет выглядеть следующим образом:

где точками обозначены внутримолекулярные водородные связи. Этот нейтральный комплекс никельдиметилглиоксим и является показателем наличия ионов никеля в растворе. Осаждение обычно проводят из разбавленных аммиачных растворов при рН=8-9. Комплекс очень устойчив; логарифм константы устойчивости равен lgβ=17, 32. Реакция весьма чувствительна: предел обнаружения m=0, 16 мкг, предельное разбавление Vlim =3∙105 мл/г. Поскольку диметилглиоксим малорастворим в воде, то предложено использовать не сам диметилглиоксим, а его двунатриевую соль, которая растворяется в воде. С помощью диметилглиоксима можно определять также и палладий(II), железо(II), висмут(III), кобальт(III). При определении никеля для устранения мешающего действия висмута, железа и кобальта ионы последних маскируют введением тиогликоевой кислоты. Небольшое количество ионов кобальта и железа можно также маскировать введением винной кислоты. Для маскирования больших количеств этих ионов рекомендуют прибавлять в раствор добавки N,N-ди(оксиэтилен)глицина. Диметилглиоксим используют и при фотометрическом определении никеля в присутствии окислителей.
1-Нитрозо-2-нафтол (α-нитрозо-β-нафтол, или реактив Ильинского)
также считается классическим органическим аналитическим реагентом. Впервые он был предложен М.А. Ильинским и Г. Кноре для гравиметрического определения кобальта в форме комплекса СоIII L3 , где HL – молекула 1-нитрозо-2-нафтола. Комплекс выделяется из растворов в виде пурпурно-красного осадка. Точная структура комплекса пока не известна. Предполагается возможность осуществления как пяти-, так и шестичленных хелатных металлоциклов типа

Комплекс очень устойчив: логарифм константы устойчивости lgβ=17. Реакция весьма чувствительна: предел обнаружения m=0, 5 мг, предельное разбавление Vlim =3∙10-5 мл/г. С использованием 1-нитрозо2-нафтола можно также определять также никель, палладий, железо.
Разработана фотометрическая методика определения кобальта с помощью рассматриваемого органического реагента.
3. РЕАКЦИИ БЕЗ УЧАСТИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ
3.1 Образование окрашенных соединений с открываемыми веществами
Дифениламин ( C 6 H 5 )2 NH при реакциях в кислой среде с соединениями, содержащими окислители (NO2 ˉ , NO3 ˉ , BrO3 ˉ , CrO4 2ˉ , MnO4 ˉ , Fe3+ и др. ) окрашивает раствор в синий цвет вследствие необратимого окисления дифениламина в синий дифенилдифенохинондиимин. Эта реакция – фармакопейная, используется для открытия, например, нитратов и нитритов. С нитратами реакция протекает по схеме:
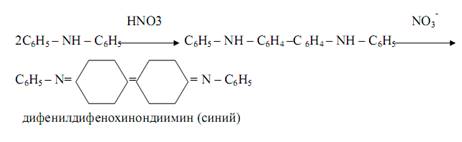
При выдерживании смеси синяя окраска постепенно переходит в бурую, а затем в жёлтую. Определению мешают сильные восстановители – такие, как сульфид-ион S2ˉ , сульльфит-ион SO3 2ˉ , тиосульфат-ион S2 O3 2ˉ , иодид-ион Iˉ .
Антипирин используют для открытия нитрит-ионов NO2 ˉ (реакция фармакопейная). В кислой среде (HCl, H2 SO4 ) нитриты образуют с антипирином нитрозоантипирин изумрудно-зелёного цвета:
NO2 ˉ + H3 O+ = HNO2 + H2 O
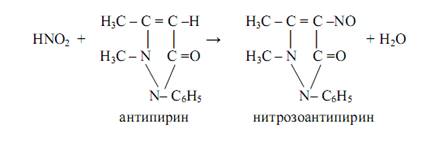
Нитраты образуют с антипирином в сильнокислой среде (концентрированная серная кислота) ярко-красный нитроантипирин

Выше уже упоминался реактив Грисса-Илошвая в качестве аналитического реагента на нитрит-ионы NO2 ˉ . При взаимодействии смеси сульфаниловой кислоты и 1-амино-2-нафтола с нитритами в нейтральных или уксуснокислых растворах образуется азокраситель ярко-красного цвета (реакция Грисса):
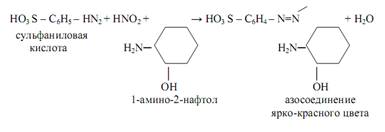
Реакция весьма чувствительная: открываемый минимум m=0, 01 мкг. Нитрат-ион NO3 ˉ такой реакции не даёт.