Курсовая работа: Производство неконцентрированной азотной кислоты
PNO=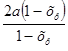 Pобщ;
Pобщ;
РO2=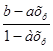 Pобщ;
Pобщ;
РNO2=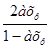 Pобщ;
Pобщ;
Подставляя значения парциальных давлений в уравнение равновесия, получим:
![]() =
=![]() P (3.3)
P (3.3)
Определим равновесную степень окисления оксида азота (II) для газа, содержащего 3,09% NO и 3,57% (об) O2 при 3,6 атм.
Тогда2a=0,0309 м.д. a=0,01545м.д. b=0,0357м.д.
LgKр =−![]() +1,75lg403-0,0005
+1,75lg403-0,0005![]() 403+2,839
403+2,839
ОткудаКр=8,546![]()
Подставляя значения Кр и парциальных давлений в уравнение (3.3)получим:
![]()
![]()
Из этого уравнения определяем ![]() .
.
В результате протекания реакции (3.1) окисляется оксида азота (II):
VNO![]() Х=
Х=![]() ;
;
Остается NO:
![]() ;
;
Расходуется кислорода на окисление
![]() ;
;
Остается кислорода:
![]() ;
;
Содержание NO2 в нитрозном газе на выходе из аппарата:
![]() ;
;
Результаты расчета материального баланса процесса окисления представлены в таблице 3.1.
Таблица 3.1.
Равновесный состав газовой смеси
| Приход | Расход | ||||||||
| Компонентный состав | нм3/т | % об | кг/т | % масс | Компонентный состав | нм3/т | % об | кг/т | % масс |
| Нитрозный газ, в т.ч. | 3789,17 | 100,00 | 3984,21 | 100,00 | Нитрозный газ, в т.ч. | 3730,64 | 100,00 | 4150,4 | 100,00 |
| NO | 117,05 | 3,09 | 223,63 | 5,61 | NO | 0,08 | 0,002 | 0,09 | 0,002 |
| NO2 | 241,01 | 6,36 | 148,55 | 3,73 | NO2 | 357,98 | 9,59 | 597,98 | 14,41 |
| O2 | 135,19 | 3,57 | 186,37 | 4,68 | O2 | 76,66 | 2,05 | 126,66 | 3,05 |
| N2 | 2691,38 | 71,03 | 3364,23 | 84,44 | N2 | 2691,38 | 71,03 | 3364,23 | 81,05 |
| H2O | 604,54 | 15,95 | 61,44 | 1,54 | H2O | 604,54 | 15,95 | 61,44 | 1,48 |
| Всего: | 3789,17 | 100,00 | 3984,21 | 100,00 | Всего: | 3730,64 | 100,00 | 4150,4 | 100,00 |
Средняя температура нитрозных газов [4]:
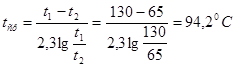
где t1-температура нитрозного газа на входе в аппарат, ![]()
t2- температура нитрозного газа на выходе из аппарата,![]()