Курсовая работа: р елементи ІV групи
Утворення потрійного зв'язку в молекулі COможна пояснити методом ВЗ. За рахунок двох неспарених електронів, які є у кожному з взаємодіючих атомів
![]()
виникають два ковалентні зв'язки:
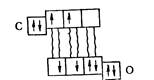
Як показує ця схема, одна з орбіталей зовнішнього електронного шару атома карбону лишається незайнятою електронами. Отже цей атом може бути акцептором електронної пари. Атом же кисню зберігає на одній з р-орбіталей неподілену електронну пару і, отже, має електроноподібні властивості. В результаті утворюється ще один ковалентний зв'язок — донорноакцепторний:
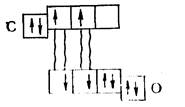
У молекулі, що утворилася таким способом, кожний з атомів має у зовнішньому шарі вісім електронів. Структуру молекули COможна подати схемою: С=О.
Тут стрілкою показано зв'язок, що утворився за донорноакцепторним
способом.
Розглянута реакція між карбоном та СО2 , що приводить до утворення оксиду карбону, відбувається у дуже великих масштабах у доменному процесі , а також у газогенераторах.
У лабораторіях оксид карбону (II) звичайно добувають, добавляючи відбирає від оцтової кислоти воду, виділяючи оксид карбону (ІІ):
НСООН = CO| + Н2 О.
Ця реакція показує, що оксид карбону (II) можна розглядати як ангідрид оцтової кислоти. Хоча оцтову кислоту не можна добути безпосередньо з оксиду карбону (II) і води, її солі утворюються при взаємодії їдких лугів з оксидом карбону при 150—200° С:
NaOH + CO = HCOONa.
На повітрі оксид карбону горить голубуватим полум'ям з виділенням великої кількості теплоти, перетворюючись в СО2 :
2СО + О2 = 2СО2 + 566 кДж.
На сонячному світлі або при наявності активованого вугілля (каталізатор) оксид карбону безпосередньо сполучається з хлором, утворюючи дуже отруйний газ — фосген:
CO+ С12 = СОС12 .
Фосген — важливий промисловий продукт. Його застосовують для виробництва ряду органічних і неорганічних речовин, наприклад
барвників.
Оксид карбону (II) сполучається з багатьма металами, утворюючи карбоніли металів, наприклад карбоніл феруму Fe(CO)6 , карбоніл нікелю Ni(CO)4 . Останні дві речовини — це леткі, дуже отруйні рідини. Більшість карбонілів металів — кристалічні речовини. Найбільше практичне значення мають карбоніли нікелю, кобальту і феруму. їх застосовують для добування металів високої чистоти ,нанесення металічних покриттів; крім того, вони є каталізаторами багатьох важливих хімічних реакцій.
Хімічні зв'язки в молекулах карбонілів металів утворені за донорно-акцепторним способом і за рахунок неспарених електронних пар молекули CO та вільних орбіталей збудженого атома металу. Наприклад, у збудженого атома феруму є п'ять незайнятих орбіталей:
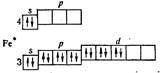
Тому молекула карбонілу феруму має склад, що відповідає формулі
Fe (CO)5 .
При підвищеній температурі оксид карбону (II) — добрий відновник, що відіграє важливу роль у металургії при відновленні металів з їхніх оксидів. Його використовують також як газоподібне паливо. Крім того, COє однією з вихідних речовин у виробництві ряду органічних сполук.
Оксид карбону дуже отруйний і особливо небезпечний тим, що не має запаху; тому отруєння ним може статися непомітно. Отруйна дія оксиду карбону, відома під назвою чаду, пояснюється тим, що CO легко сполучається з гемоглобіном крові і робить його нездатним переносити кисень від легень до тканин. Якщо вдихати свіже повітря, то утворена сполука (карбоксигемоглобін) поступово руйнується, і гемоглобін відновлює здатність вбирати кисень.
Сполуки карбону з сульфуром і нітрогеном. З сполук карбону з сульфуром і нітрогеном велике практичне значення мають сульфід карбону CS2 та ціаністоводнева (синильна) кислота HCN.
Сульфід карбону CS2 добувають пропусканням пари сульфуру крізь шар розжареного карбону. Це безбарвна летка рідина, що сильно заломлює світло, кипить при 46° С. При тривалому зберіганні сульфід карбону стає жовтим і набуває неприємного запаху.
Сульфід карбону отруйний і легко загоряється. У ньому добре розчиняються сульфур, фосфор, йод, різні жири і смолисті речовини.
Ціаністоводнева кислота HCN. При високій температурі, наприклад в електричній дузі, карбон може безпосередньо сполучатися з нітрогеном, утворюючи безбарвний отруйний газ диціан, молекулярна маса якого відповідає формулі C2 N2 . За своїми хімічними властивостями диціан трохи схожий на галогени. Подібно до них, він утворює сполуку з гідрогеном HCN, що має кислотні властивості і дістала назву ціаністоводневої, або синильної, кислоти.
Ціаністоводнева кислота—безбарвна, дуже летка рідина, кипить при 26,7° С і має характерний запах гіркого мигдалю.
У водному розчині ціаністоводнева кислота лише незначною міроюдисоціює на іони
(К = 8 • 10-10 ).
Ціаністоводнева кислота — сильна отрута, що діє смертельно навіть у мізерних дозах (менше 0,05 г).
Солі ціаністоводневої кислоти називаються ціанідами.З них найбільше застосовується ціанід калію.
Ціанід калію KCN — безбарвні кристали, що добре розчиняються у воді. Ціанід калію так само отруйний, як і синильна кислота. На повітрі під дією СО2 він досить швидко розкладається, виділяючи синильну кислоту і перетворюючись на карбонат:
2KCN+ Н2 О + СО2 = К2 СО3 + 2HCN.