Курсовая работа: Расчет химического равновесия и термодинамический анализ реакционной системы
Решение:
Проведем предварительный расчет процесса. Для этого необходимо ввести допущение, что побочных реакций не протекает, селективность процесса по целевому продукту 100%, то есть упрощенная схема реакции имеет вид:
![]()
Для определения параметров процесса необходимо определить термодинамические данные веществ, участвующих в реакции:
Для изопентана:
| Т, К | ∆Н, кДж/моль | S,Дж/моль*К |
| 298 | -154,47 | 343,59 |
| 300 | -154,68 | 344,34 |
| 400 | -163,64 | 383,34 |
| 500 | -171,00 | 420,74 |
| 600 | -176,86 | 456,39 |
| 700 | -181,33 | 490,28 |
| 800 | -184,64 | 522,37 |
| 900 | -186,82 | 552,79 |
| 1000 | -188,03 | 581,62 |
Для изобутилена:
| Т, К | ∆Н, кДж/моль | S,Дж/моль*К |
| 298 | -16,90 | 293,59 |
| 300 | -17,03 | 294,18 |
| 400 | -22,72 | 322,92 |
| 500 | -27,61 | 349,87 |
| 600 | -31,71 | 375,26 |
| 700 | -35,02 | 399,15 |
| 800 | -37,66 | 421,66 |
| 900 | -39,62 | 442,96 |
| 1000 | -40,96 | 463,13 |
Для метана:
| Т, К | ∆Н, кДж/моль | S,Дж/моль*К |
| 298 | -74,85 | 186,27 |
| 300 | -74,89 | 186,52 |
| 400 | -77,95 | 197,44 |
| 500 | -80,75 | 207,15 |
| 600 | -83,26 | 216,15 |
| 700 | -85,35 | 224,68 |
| 800 | -87,11 | 232,80 |
| 900 | -88,49 | 240,58 |
| 1000 | -89,54 | 248,03 |
Для воды, которая служит инертным разбавителем в данном процессе:
| Т, К | ∆Н, кДж/моль | S,Дж/моль*К |
| 298 | -241,84 | 188,74 |
| 300 | -241,84 | 188,95 |
| 400 | -242,84 | 198,70 |
| 500 | -243,84 | 206,48 |
| 600 | -244,76 | 212,97 |
| 700 | -245,64 | 218,66 |
| 800 | -246,48 | 223,76 |
| 900 | -247,19 | 228,36 |
| 1000 | -247,86 | 232,67 |
На основании полученных результатов определяем для температурного диапазона термодинамические параметры процесса, константу равновесия и степень конверсии реагентов:
![]()
![]()
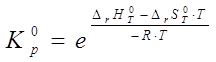 ,
,
![]()
| Т, К | Кр 0 | Кр , кПа | ||
| 298 | 62718,16 | 136,27 | 0,0001 | 0,01 |
| 300 | 62760,00 | 136,36 | 0,0002 | 0,02 |
| 400 | 62969,20 | 137,03 | 0,0860 | 8,71 |
| 500 | 62634,48 | 136,27 | 3,7567 | 380,65 |
| 600 | 61881,36 | 135,02 | 46,2817 | 4689,49 |
| 700 | 60960,88 | 133,55 | 267,4475 | 27099,12 |
| 800 | 59873,04 | 132,09 | 978,1709 | 99113,17 |
| 900 | 58701,52 | 130,75 | 2647,6177 | 268269,87 |
| 1000 | 57530,00 | 129,54 | 5772,6704 | 584915,83 |
Для данного процесса степень конверсии рассчитывается по формуле:
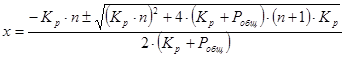
Рассчитаем равновесную степень конверсии при давлении 1 атм, отсутствии инертных разбавителей. Результаты расчетов приведены в таблице:
| Т, К | х |
| 298 | 0,01 |
| 300 | 0,01 |
| 400 | 0,28 |
| 500 | 0,89 |
| 600 | 0,99 |
| 700 | 1,00 |
| 800 | 1,00 |
| 900 | 1,00 |
| 1000 | 1,00 |
График зависимости представлен на рисунке:
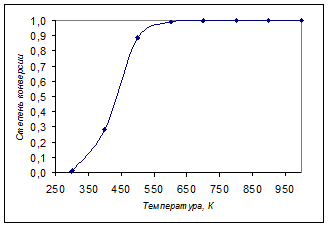
Как видно, для ведения процесса подходит температура в интервале от 600 до 800К.
Состав равновесной смеси при изменении температуры ведения процесса представлен в таблице:
| Т, К | Мол. доля в равновесной смеси | |||
| изопентан | изобутилен | метан | вода | |
| 298 | 0,9772 | 0,0114 | 0,0114 | 0,0000 |
| 300 | 0,9753 | 0,0124 | 0,0124 | 0,0000 |
| 400 | 0,5608 | 0,2196 | 0,2196 | 0,0000 |
| 500 | 0,0589 | 0,4705 | 0,4705 | 0,0000 |
| 600 | 0,0053 | 0,4973 | 0,4973 | 0,0000 |
| 700 | 0,0009 | 0,4995 | 0,4995 | 0,0000 |
| 800 | 0,0003 | 0,4999 | 0,4999 | 0,0000 |
| 900 | 0,0001 | 0,5000 | 0,5000 | 0,0000 |
| 1000 | 0,0000 | 0,5000 | 0,5000 | 0,0000 |

Поскольку процесс идет с повышением числа молей газа, имеет смысл создавать вакуум. Рассчитаем для диапазона давлений 0,1-1,2 атм и интервала температур 600-800К и отсутствии инертных разбавителей равновесную степень конверсии реагента:
| Р, атм | Р, кПа | х (Т=600K) | х (Т=700K) | х (Т=800K) |
| 0,1 | 10,1325 | 0,9989 | 0,9998 | 0,9999 |
| 0,2 | 20,2650 | 0,9978 | 0,9996 | 0,9999 |
| 0,3 | 30,3975 | 0,9968 | 0,9994 | 0,9998 |
| 0,4 | 40,5300 | 0,9957 | 0,9993 | 0,9998 |
| 0,5 | 50,6625 | 0,9946 | 0,9991 | 0,9997 |
| 0,6 | 60,7950 | 0,9936 | 0,9989 | 0,9997 |
| 0,7 | 70,9275 | 0,9925 | 0,9987 | 0,9996 |
| 0,8 | 81,0600 | 0,9915 | 0,9985 | 0,9996 |
| 0,9 | 91,1925 | 0,9904 | 0,9983 | 0,9995 |
| 1 | 101,3250 | 0,9894 | 0,9981 | 0,9995 |
| 1,1 | 111,4575 | 0,9883 | 0,9979 | 0,9994 |
| 1,2 | 121,5900 | 0,9873 | 0,9978 | 0,9994 |

Зависимость состава равновесной смеси от давления при температуре 800К показана в таблице:
| Мол. доля в равновесной смеси | ||||
| Р, атм | изопентан | изобутилен | метан | вода |
| 0,1 | 0,0000 | 0,5000 | 0,5000 | 0,0000 |
| 0,2 | 0,0001 | 0,5000 | 0,5000 | 0,0000 |
| 0,3 | 0,0001 | 0,5000 | 0,5000 | 0,0000 |
| 0,4 | 0,0001 | 0,4999 | 0,4999 | 0,0000 |
| 0,5 | 0,0001 | 0,4999 | 0,4999 | 0,0000 |
| 0,6 | 0,0002 | 0,4999 | 0,4999 | 0,0000 |
| 0,7 | 0,0002 | 0,4999 | 0,4999 | 0,0000 |
| 0,8 | 0,0002 | 0,4999 | 0,4999 | 0,0000 |
| 0,9 | 0,0002 | 0,4999 | 0,4999 | 0,0000 |
| 1 | 0,0003 | 0,4999 | 0,4999 | 0,0000 |
| 1,1 | 0,0003 | 0,4999 | 0,4999 | 0,0000 |
| 1,2 | 0,0003 | 0,4998 | 0,4998 | 0,0000 |

Однако проводить процесс при вакууме опасно, в связи с высокой взрывоопасностью. Гораздо удобнее применять для ведения процесса инертные разбавители.
Рассчитаем зависимость равновесной степени конверсии от степени разбавления водой – инертным разбавителем при 800К, 700К, 600К и пониженном давлении 0,5атм. Результаты расчетов приведены в таблице.
| n | х (Т=600K) | х (Т=700K) | х (Т=800K) |
| 0 | 0,9946 | 0,9991 | 0,9997 |
| 1 | 0,9964 | 0,9994 | 0,9998 |
| 5 | 0,9985 | 0,9997 | 0,9999 |
| 10 | 0,9991 | 0,9998 | 1,0000 |
| 15 | 0,9994 | 0,9999 | 1,0000 |
| 20 | 0,9995 | 0,9999 | 1,0000 |
| 25 | 0,9996 | 0,9999 | 1,0000 |
| 30 | 0,9997 | 0,9999 | 1,0000 |
| 35 | 0,9997 | 0,9999 | 1,0000 |
| 40 | 0,9997 | 1,0000 | 1,0000 |
| 45 | 0,9998 | 1,0000 | 1,0000 |
| 50 | 0,9998 | 1,0000 | 1,0000 |

Рассчитаем зависимость равновесной степени конверсии от степени разбавления водой – инертным разбавителем при 800К, 700К, 600К и пониженном давлении 1атм. Результаты расчетов приведены в таблице.
| n | х (t=600K) | х (t=700K) | х (t=800K) |
| 0 | 0,9894 | 0,9981 | 0,9995 |
| 1 | 0,9929 | 0,9988 | 0,9997 |
| 5 | 0,9969 | 0,9995 | 0,9999 |
| 10 | 0,9982 | 0,9997 | 0,9999 |
| 15 | 0,9987 | 0,9998 | 0,9999 |
| 20 | 0,9990 | 0,9998 | 1,0000 |
| 25 | 0,9992 | 0,9999 | 1,0000 |
| 30 | 0,9993 | 0,9999 | 1,0000 |
| 35 | 0,9994 | 0,9999 | 1,0000 |
| 40 | 0,9995 | 0,9999 | 1,0000 |
| 45 | 0,9995 | 0,9999 | 1,0000 |
| 50 | 0,9996 | 0,9999 | 1,0000 |