Курсовая работа: Розроблення системи автоматизації процесу очищення нікельмістких стічних вод
Реакція нейтралізації йде по схемі:
H+ + OH - = H2 O (1.1)
Високі концентрації ОН - іонів у воді обумовлені надлишком вільних лугів (гідроксидів натрію, калія і лужноземельних металів). Їх нейтралізація досягається додаванням до стічних вод мінеральних кислот (сірчаної, соляної і ін).
Проте, як правило, кислі стічні води, нанесення гальванічних покриттів, що утворюються в процесах, містять також іони заліза і важких металів в концентраціях, що часто набагато перевищують концентрації вільних кислот. Тому практично нейтралізація кислот в чистому вигляді зустрічається вельми рідко. В більшості випадків вона супроводжується реакціями хімічного осадження перетворення іонів металів в важкорозчинні гідроксиди, що випадають в осад.
Утворення гідроксидів йде по схемах:
Ме2+ + 2ОН - Ме (ОН) 2 ¯ (1.2)
Ме3+ + 3ОН - Ме (ОН) 3 ¯ (1.3)
Таким чином, при нейтралізації кислих стічних вод їдкі луги витрачаються як на зниження концентрації в них Н+ - іонів, так і на утворення гідроксидів важких металів. У ряді випадків на осадження іонів металів витрачається значно більше реагенту, чим на нейтралізацію вільних кислот.
Для нейтралізації кислих стічних вод можна застосовувати наступні лужні реагенти: оксид кальцію (негашене вапно), гідроксид кальцію (гашене вапно), їдкий натр, карбонат кальцію (вапняк, крейда, мармур), карбонат магнію (магнезит), карбонат натрію (кальцинована сода).
Для нейтралізації стічних вод найчастіше застосовують вапно, яке додають у воду у вигляді грубої суспензії - вапняного молока. При нейтралізації вапном стічних вод, що містять вільну сірчану кислоту і її солі, утворюється сульфат кальцію, який досягши певної концентрації випадає в осад. Присутній у вапняному молоці шлам сприяє коагуляції частинок гідроксидів металу і інших нерозчинних домішок. Розчинність осаду залежить від його структури, яка в свою чергу визначається умовами проведення процесу нейтралізації
Теоретичні витрати деяких реагентів на реакцію приведені в таблиці 1.1
Таблиця 1.1 - Теоретична витрата реагентів на осадження металів з розчинів
| ІОН | Витрата реагенту на 1гр іона металу, г | |||
| СаО | СаО | |||
| Cu2+ | 0.88 | 1.16 | 1.26 | 1.67 |
| Fe3+ | 1.51 | 1.99 | 2.15 | 2.85 |
| Fe2+ | 1.00 | 1.32 | 1.43 | 1.90 |
| Zn2+ | 0.86 | 1.13 | 1.22 | 1.62 |
| Al3+ | 3.11 | 4.11 | 4.45 | 5.89 |
| Ni2+ | 0.95 | 1.26 | 1.36 | 1.81 |
| Cr3+ | 1.61 | 2.13 | 2.31 | 3.06 |
Розчинність сульфату кальцію при 20°С складає 2 г/л. При нейтралізації вапном стічних вод, що містять азотну і соляну кислоти і їх солі, утворюються відповідно нітрат і хлорид кальцію, розчинність яких при 20°С достатньо велика і складає декілька сотень грамів на літр.
При нейтралізації надмірної кислотності величина рН стічних вод підвищується, що супроводжується утворенням і осадженням основних солей і гідроксидів металу. Величина рН, відповідна початку осадження гідроксидів різних металів, залежить від природи металів, концентрації їх в розчині, а також від температури, наявності сторонніх домішок і т.п.
Проте при взаємодії розчинних у воді солей (іонів) металу з вапном і їдким натром утворюються осад, основні солі металу, що є головним чином. У середовищі з ще більшою лужністю тверда фаза є в основному відповідним гідроксидом металу.
Утворення гідроксидів відбувається в декілька стадій: спочатку утворюються гидроксоіони, які поступово полімеризуються, що супроводжується їх дегідратацією і мицеліоутворенням, а потім наступає флокуляція. Структура осаду, що утворюється, з часом змінюється (відбувається його старіння), унаслідок чого іноді значно знижується його розчинність. Гідроксиди деяких металів (цинку, міді, хрому, алюмінію і ін) розчиняються в надлишку їдкого лугу з утворенням комплексних аніонів.
У разі досягнення значень розчинності в процесі очищення стічних вод забезпечується ГДК 10-1 -10-2 мг/дм3 важких металів. Проте загальновідомо, що при осаджувальному очищенні стічних вод гальванічного виробництва ГДК часто не досягається.
Гідроксиди важких металів, що одержуються при очищенні стічних вод, є сильно обводнюючі (99,5%) опади, розчинність яких залежить від безлічі чинників: рН, сольового складу, іонної сили розчину та інші.
Для з'ясування причин неповного осадження гідроксидів важких металів розглянемо процес їх утворення. З фізико-хімічної точки зору, це направлений гідроліз солей:
Men+ + nH2 O = Me (OH) n +nH+ (1.4)
Користуючись цією схемою, розрахуємо значення рН осадження по формулі:
pH= - lg aН+ =![]() lg ПР - lg Kw - lg aMen+ , (1.5)
lg ПР - lg Kw - lg aMen+ , (1.5)
де ПР - коефіцієнт розчинності
Кw - іонний коефіцієнт води, 10-14
аМеn+ - активність іонів металів в розчині.
Залежність рН осадження від активності іонів металу в розчині приведена на рисунку 1.1
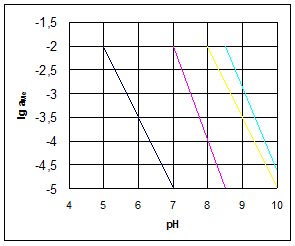
Рисунок 1.1 - Залежність рН почала утворення гідроксидів важких металів від активності металів в розчині.
Значення рН початку осадження, розраховані на підставі усереднених показників, а також значення рН, необхідні для забезпечення заданих залишкових концентрацій, приведені в таблиці 1.2