Курсовая работа: Синтез нитробензойной кислоты
Тиле, усовершенствуя формулу Кекуле, утверждал, что двойные связи в последнем не фиксированы, а постоянно перемещаются-«осциллируют», а Дьюар и Хюккель предложили структурные формулы бензола с двойными связями и малыми циклами.
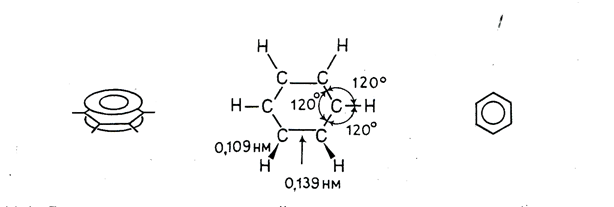
В настоящее время на основании данных многочисленных исследований можно считать твердо установленным, что шесть углеродных и шесть водородных атомов в молекуле бензола находятся в одной плоскости и что облака π-электронов атомов углерода перпендикулярны плоскости молекулы и, следовательно, параллельны друг другу и взаимодействуют между собой. Облако каждого π-электрона перекрывается облаками π-электронов соседних углеродных атомов. Реальная молекула бензола с равномерным распределением π-электронной плотности по всему кольцу может быть представлена в виде плоского шестиугольника, лежащего между двумя торами.
Отсюда следует, что формулу бензола логично изображать в виде правильного шестиугольника с кольцом внутри, подчеркивая тем самым полную делокализованность π-электронов в бензольном кольце и равноценность всех углерод-углеродных связей в нем. Справедливость последнего заключения подтверждена, в частности, результатами измерения длин С—С-связей в молекуле бензола; они одинаковы и равны 0,139 нм (С—С-связи в бензольном кольце короче ординарных (3,154 нм), но длиннее двойных (0,132 нм)). Распределение электронной плотности в молекуле бензола; длины связей, валентные углы
Бензойная кислота простейшая ароматическая кислота, C6 H5 COOH; бесцветные блестящие пластинки или иглы с Тпл. 121,5°С, кристаллогидрат плавится при 90 °С. Встречается в свободном состоянии в некоторых смолах, особенно в бензойной смоле и в «драконовой крови» (красная твердая смола, добываемая из одного вида пальмы). В виде бензилового эфира она входит в состав перуанского бальзама. Б. к. в виде сложных эфиров и солей содержится в различных природных эфирных маслах, например гвоздичном. В виде гиппуровой кислоты (бензоилглицин) содержится в моче травоядных животных. Впервые выделена возгонкой в начале 17 в. из бензойной смолы (росного ладана), отсюда и получила название. Б. к. хорошо растворяется в органических растворителях, в воде - плохо; легко возгоняется; перегоняется с водяным паром. Получают Б. к. окислением толуола азотной или хромовой кислотой, а также декарбоксилированием фталевой кислоты.
В медицине её применяют при кожных заболеваниях наружно как антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а натриевую соль Б. к. - как отхаркивающее средство. Кроме того, натриевую соль Б. к. используют при консервировании пищевых продуктов. Сложные эфиры Б. к. (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные Б. к., например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей. Эталон в калориметрии; основное вещество для установки титра щелочей; для бензилирования в органическом анализе; растворитель при определении молекулярного веса; для контроля достигавшейся максимальной температуры в стерилизаторах. В продаже часто фальсифицируется мылом, сахаром и многими кислотами. Фальсифицированная Б. К. дает на нагретом стекле твердый осадок.
ТЕХНИЧЕСКИЕ ПОКАЗАТЕЛИ (СТ. ГОХП 27 - 1810)
| квалиф |
осн. вещ. % |
Т.пл °С |
Предельно допустимое содержание примесей % |
Испытания (см. СТ. ГОХП) | |||
| хлориды | ост. прокал. | сера |
тяж. мет. | ||||
| ч.д.а. | 99,9 | 122-123 | 0,02 | 0,01 | 0,002 | 0,0005 |
На растворимость в аммиаке |
| ч. | 99,5 | 122-123 | 0,05 | 0,05 | 0,005 | 0,002 | |
Очень важным производным бензойной кислоты является ее хлорангидрид — хлористый бензоил. Это жидкость с характерным запахом и сильным лакриматорным действием. Используется как бензоилирующий агент.
Пероксид бензоила используется как инициатор для реакций полимеризации, а также как отбеливающий агент для пищевых масел, жиров, муки.
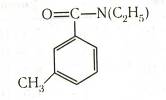
Толуиловые кислоты. Метилбензойные кислоты называют толуиловыми кислотами. Они образуются при частичном окислении о-, м- и п -ксилолов. NN-Диэтил-м -толуилмид является эффективным репеллентом — препаратом, отпугивающим насекомых:
п-трет -Бутилбензойную кислоту получают в промышленных масштабах жидкофазным окислением трет -бутилтолуола в присутствии растворимой соли кобальта в качестве катализатора. Применяется в производстве полиэфирных смол.
Фенилуксусную кислоту получают из хлористого бензила через нитрил или через магнийорганические соединения. Это кристаллическое вещество с т. пл. 76 °С. Благодаря подвижности подородных атомов метиловой группы легко вступает в реакции конденсации. Эта кислота и ее эфиры применяются в парфюмерии.
СЕРНАЯ КИСЛОТА H2 SO4 — сильная двухосновная кислота. Безводная 100%-ная С. к. при комнатной температуре представляет собой в сильной степени ассоциированное соединение с длинными, образованными на счет водородных связей, цепевидными молекулами. При повышении температуры эти цепочки разрушаются
Физические и химические свойства серной кислоты. Безводная С. к.— бесцветная маслянистая жидкость, застывающая в кристаллич. массу при +10,37°. При 279,6С /700 мм безводная С. к. кипит с разложением до образования азеотрошюй смеси, содержащей 98,3% H2 SO4 и 1,7% Н2 О (эта смесь кипит при 338,8°). С. к. смешивается с водой и SO3 в любых соотношениях. Добавление воды к 100%-иой С. к. приводит к снижению температуры плавления (ок. 120 на 1мольводы), отвечающему образованию почти 2 частиц из каждой молекулы воды.
Теплота испарения составляет 122,1 ккал/кг 100%-ной С. к., теплота плавления 26,55 ккал/кг 100%-ной С. к.
Конц. С.к. — довольно сильный окислитель, особенно при нагревании. Она окисляет HJ и частично HВr (но не HCI) до свободных галогенов, уголь до С02 , серу до SO2 , а также многие металлы (Сu, Hg и р.)- Золото и платина устойчивы но отношению к С. к. при любых концентрациях и температурах. С. к. с концентрацией выше 93% не действует на железо. Разб. С. к. легко растворяет железо с выделением Н2 . Окислительные свойства для разб. С. к. нехарактерны. Действуя как окислитель, С. к. обычно восстанавливается до SO2 . Однако наиболее сильными восстановителями она может быть восстановлена до S и даже H2 S. Копц. С. к. частично восстанавливается газообразным Н2 , из-за чего и не может применяться для его сушки.
С. к. дает два ряда солей: средние — сульфаты, и кислые — бисульфаты, причем последние в твердом состоянии выделены лишь для немногих наиболее активных одновалентных металлов — Na, К и др
Получение. В современной заводской практике исходным веществом для получения С. к. служит сернистый газ. Процесс его переработки в С. к. может быть выражен суммарным стехиометрическим уравнением: