Курсовая работа: Синтез нитробензойной кислоты
Выполнил студент
3 курса, 3 группы
Кириллов Евгений Владимирович
Научный руководитель
Д.х.н., профессор Моисеев И.К.
САМАРА 2007
СОДЕРЖАНИЕ
Содержание
1. Введение
2. Обзор литературы
3. Обсуждение результатов
4. Экспериментальная часть
4.1. Реагенты и оборудование
4.2. Методика эксперимента
5. Выводы
6. Библиография
1. Введение
Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с углеродными атомами бензольного ядра. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические.
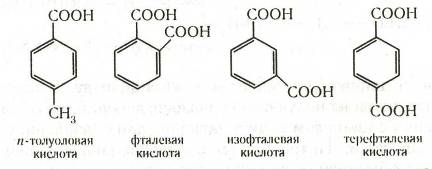
Ароматические кислоты могут быть разделены по количеству карбоксильных групп на одно-, двух- и более основные. Названия кислот, у которых карбоксильная группа непосредственно связана с ядром, производятся от ароматических углеводородов. Названия кислот с карбоксилом в боковой цепи производятся обычно от наименований соответствующих кислот жирного ряда. Наибольшее значение имеют кислоты первого типа: например, бензойная (бензолкарбоновая) С6 Н5 —СООН, п- толуиловая
(п -толуолкарбоновая), фталевая (1,2-бензолдикарбоновая), изофталевая (1,3-бензолдикарбоновая), терефталевая (1,4-бензолдикарбоновая):
Из кислот второго типа отметим фенилуксусную кислоту (I), метилфенилуксусную,
или 2-фенилпропановую, кислоту ( II):
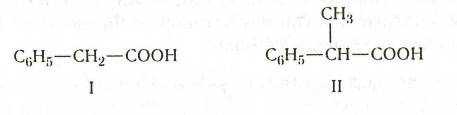
Физические свойства
Монокарбоновые кислоты ряда бензола — бесцветные кристаллические вещества с температурой плавления выше 100 °С. Кислоты с пара- положением заместителей плавятся при значительно более высоких температурах, чем их изомеры. Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. Монокарбоновые кислоты довольно плохо растворяются в холодной воде и значительно лучше в горячей. Низшие кислоты летучи с парами воды.
В водных растворах монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6·10-5 , уксусной кислоты 1,8·10-5 .
Отдельные представители. Применение
Бензол был открыт Фарадеем в 1825 г. и была установлена его брутто-формула-С6 Н6 . В 1865 г. Кекуле предложил его структурную формулу как циклогексатриена-1,3,5. Этой формулой пользуются и в настоящее время, хотя она, как позднее будет показано, несовершенна - не отвечает полностью свойствам бензола.
Наиболее характерной особенностью химического поведениябензола является удивительная инертность двойных углерод-углеродных связей в его молекуле: в отличие от рассмотренных; ранее непредельных соединений он устойчив к действию окислителей (например, перманганата калия в кислой и щелочной среде, хромового ангидрида в уксусной кислоте) и не вступает в обычные реакции электрофильного присоединения, характерные для алкенов, алкадиенов и алкинов.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--