Курсовая работа: Синтез, свойства и применение дифениламина. Амины и их свойства
Образование производных мочевины
Соли первичных и вторичных аминов с циановой кислотой более или менее легко изомеризуются с образованием замещенных производных мочевины
RNH2 HCNO -—> RNHCONH2
Эта реакция аналогична превращению циановокислого аммония в мочевину. Следующие примеры иллюстрируют применение этого способа. Первичные и вторичные амины легко реагируют с эфирами изоциановой кислоты с образованием производных мочевины. Обычно для этой цели применяют фенилизоцианат, который нагревают с эквимолекулярным количеством амина в каком-либо не содержащем гидроксила растворителе, например в петролейном эфире.
![]()
Совершенно необходимо предохранять реакционную смесь от доступа влаги и применять лишь тщательно обезвоженные растворитель и амин, так как фенилизоцианат реагирует с водой с образованием дифенилмочевины. α-Нафтилизоцианат более удобен в этом отношении, чем фенилизоцианат, так как он менее чувствителен к действию воды и поэтому при реакции образуется меньшее количество нежелательных побочных продуктов.
Фенилизотиоцианат (фенилгорчичное масло) реагирует с аминами аналогичным образом с образованием соответственных производных тиомочевины. Реакция эта осуществляется в тех же условиях, как и с фенилизоцианатом.
Алкилирование первичных и вторичных аминов
Последовательное замещение алкильными группами атомов водорода, находящихся у азота в первичных аминах, ведет к образованию вторичных и третичных аминов. Введение алкильных групп легко достигается действием на амин соответственного галоидного алкила или алкилсульфата. Состав конечного продукта реакции зависит в значительной степени от относительных количеств взятых в реакцию компонентов, а также и от условий опыта, и обычно очень трудно получить при алкилировании только одно из возможных производных амина и поэтому продукт реакции, как правило, представляет собой смесь вторичного и третичного аминов наряду с значительным количеством непрореагировавшего первичного амина, а часто с примесью некоторого количества соли четвертичного аммониевого основания. Получение сложной смеси при применении галоидного алкила является результатом образования при реакции галоидоводорода, который дает соли с находящимися в реакционной смеси аминами. Распределение галоидоводорода между аминами зависит от их относительной основности, их сравнительного количества, а также от растворимости солей аминов в реакционной смеси. При алкилировании ароматических аминов выделяющийся осадок обычно содержит значительное количество соли исходного амина, а в растворе остается алкилированный амин, который вступает в дальнейшую реакцию с галоидным алкилом. Такие затруднения могут быть преодолены, по крайней мере, до известной степени проведением алкилирования в присутствии веществ, способных связывать образующийся галоидозодород, например, углекислой или двууглекислой соли щелочного металла. Для выделения вторичных аминов, наряду с вышеупомянутыми способами, обычно, за исключением некоторых особых случаев, пользуются способностью вторичных аминов образовывать нитрозамины. При восстановлении нитрозаминов оловом с соляной кислотой или при нагревании их с минеральными кислотами получаются чистые вторичные амины. Другой способ, по которому удается получать вторичные амины с значительно лучшими выходами, основан на способности металлических производных многих замещенных амидов типа RCONHR реагировать с галоидными алкилами. Из продукта алкилирования при гидролизе получается вторичный амин
![]()
Для этой цели удобно пользоваться ацетанилидом и его гомологами. Кроме того, применялись и формильные производные первичных ароматических аминов, а также арилсульфонильные производные первичных аминов.
Другой способ получения гомологов метиланилина заключается в нагревании галоидного алкила с большим избытком ароматического амина. По окончании реакции избыток ароматического амина осаждают прибавлением водного раствора хлористого цинка. Этот способ применялся для получения многих алкиланилинов с вполне удовлетворительными результатами. Таким же путем могут быть получены алкиланилины, содержащие третичную алкильную группу. Для алкилирования аминов также можно пользоваться ди-алкилсульфатами. Впрочем, обычно, этот способ ограничивается применением имеющегося в продаже диметилсульфата. Алкилирование по этому способу проводится в индиферентном растворителе или в присутствии водной щелочи, причем последняя модификация имеет более широкое применение. Вместо диалкилсульфатов можно1 применять эфиры арилсульфоновых кислот. Спирты вступают в реакцию с солями первичных ароматических аминов, примерно, при 200° с образованием моно- и диалкилариламинов. Эта реакция имеет применение в промышленности; для получения метиланилина нагревают при 180° смесь 55 частей солянокислого анилина и 16 частей метилового спирта. Для получения диметиланилина смесь 80 частей анилина, 78 частей метилового спирта и 8 частей серной кислоты нагревают в автоклаве до 235°. В лабораторных условиях можно вместо серной кислоты пользоваться другим катализатором, например йодом. Еще более активным катализатором в этой реакции является смесь порошкообразной меди с бромистым натрием или смесь галоидных солей меди и натрия Вторичные амины могут быть также получены восстановлением. Эта реакция может быть осуществлена электролитическим путем, действием цинковой пыли и водной щелочи натрия в спиртовой среде или муравьиной кислоте.
Новый способ получения метальных производных α- и β-нафтиламинов предложен Родионовым и Введенским. Для получения моно- и диметильных производных применяется действие метилового эфира р-толуолсульфоновой кислоты на соответствующий амин.
Другой интересный способ получения вторичных аминов основан на взаимодействии азометинов с йодистыми алкилами, причем образуются соединения, которые по прибавлении воды или спирта расщепляются на вторичный амин и альдегид.
![]()
Арилирование первичных и вторичных аминов
Введение в аминогруппу ароматического остатка обычно сопряжено с некоторыми затруднениями, вследствие малой реакционноспособности галоида в ароматических соединениях. Например, хлорбензол и бромбензол не вступают в реакцию с анилином в условиях, аналогичных применяемым для получения этиланилина. Впрочем, в присутствии медной бронзы или йодистой меди эта реакция протекает более гладко.
При взаимодействии третичных аминов с йодистыми алкилами образуются соли четвертичных аммониевых оснований. Общий способ получения таких соединений состоит в смешении обоих компонентов, иногда в каком-либо подходящем растворителе. Реакция протекает при комнатной температуре или при нагревании по схеме.
R'"R"R'N + RHal —> R'"R"R'RNHal
Вместо галоидных алкилов можно пользоваться диалкилсульфатами или алкиловыми эфирами ароматических сульфоновых кислот, причем получаются сернокислые или арилсульфоновокислые соли соответствующих четвертичных аммониевых оснований.
Реакция образования солей четвертичных аммониевых оснований часто применяется для идентификации третичных аминов, причем в качестве реактива наибольшее применение имеет йодистый метил. Рекомендуется также пользоваться для этой цели метиловым эфиром р-толуолсульфоновой кислоты. Ниже приводятся общие условия реакции для получения р-толуол-сульфоновокислых солей четвертичных аммониевых оснований.
При взаимодействии третичных аминов с йодистыми алкилами образуются соли четвертичных аммониевых оснований. Общий способ получения таких соединений состоит в смешении обоих компонентов, иногда в каком-либо подходящем растворителе. Реакция протекает при комнатной температуре или при нагревании по схеме
R'"R"R'N + RHal —> R'"R"R'RNHal
Вместо галоидных алкилов можно пользоваться диалкилсульфатами или алкиловыми эфирами ароматических сульфоновых кислот, причем получаются сернокислые или арилсульфоновокислые соли соответствующих четвертичных аммониевых оснований.
Соли четвертичных аммониевых оснований образуются не только в результате взаимодействия галоидных алкилов или эфиров ароматических сульфоновых кислот с третичными амидами, но и при действии эфиров йодуксусной кислоты на некоторые амины. Легче других вступают в эту реакцию бензилпиперидин, алифатические третичные амины и хинолин. В некоторых случаях для получения четвертичных аммониевых солей.
Легкость образования четвертичных аммониевых солеи сильно зависит от характера исходных соединений.
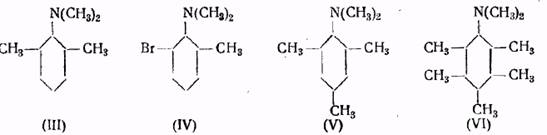
Наличие заместителей в о-положении к аминогруппе оказывает замедляющее действие на скорость реакции, что ясно видно из сравнения констант, для диметил-о -, -т - и р -толуидина, а также для хинолина и изохинолина. Это явление еще более резко выражено при наличии двух заместителей в о -положении к аминогруппе.
Например, третичные амины (III) и (IV) не реагируют с йодистым метилом при 100°, тогда как изомерные им амины, обладающие другим строением, сравнительно легко образуют четвертичные аммониевые соли