Курсовая работа: Синтез тиоцианата ртути
2 NH 4 NCS р + I 2 = 2 NH 4 I + ( SCN )2
KNCS + Fe = KCN + FeS
2KNCS + Pb(NO3 )2 = Pb(SCN)2 + 2KNO3
Тиоцианаты щелочных металлов и аммония разлагаются при нагревании, например:

Термическая изомеризация NH4 NCS положена в основу промышленного получения тиомочевины:
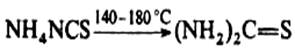
Токсичность тиоцианатов сравнительно невелика (например: KNCS раздражает кожу, при длительном воздействии угнетает щитовидную железу, поражает почки; NH4 NCS вызывает явление ксантопсии, т. е. видение предметов в желтом цвете). Токсичность других тиоцианатов, например Pb(SCN)2 или Hg(SCN)2 , во многом определяется физиологическим воздействием входящих в них металлов. Тиоциановая кислота содержится в соке лука Allium соера и в корнях других растений. Тиоцианаты в небольших количествах найдены в слюне и в желудочном соке животных. В слюне человека содержится в среднем 0,01% SCN- , в крови около 1,3 мг в 100 мл в виде KNCS.
2.4.2 Получение тиоцианатов
Основные методы получения HNCS – это взаимодействие (Э)NCS с KHSO4 или ионный обмен водных растворов NH4 NCS (получают нагреванием смеси аммиака и сероуглерода).Родан или тиоциан обычно получают по реакциям:
Cu(SCN)2 = CuSCN + 0,5(SCN)2
Hg(SCN)2 + Вr2 = HgBr2 + (SCN)2
Тиоцианаты щелочных металлов и аммония получают при улавливании цианистых соединений, содержащихся в коксовом газе, растворами соответствующих полисульфидов. Кроме того, NH4 NCS получают взаимодействием NH3 с CS2 , a KNCS и NaNCS получают сплавлением KCN или NaCN с серой.
KCN + S = KSCN (сплавление)
Другие тиоцианаты синтезируют обменной реакцией сульфатов, нитратов или галогенидов металлов с тиоцианатом Ba, К или Na:
KSCN + AgNO 3 = AgSCN + KNO 3
или взаимодействием гидроксидов или карбонатов металлов с HNCS:
HSCN + NaOH = NaSCN + H 2 O
CuSCN получаются из тиоцианатов щелочных металлов, гидросульфита натрия и сульфата меди. Ca(SCN)2 *3H2 O получают действием оксида кальция на тиоцианат аммония.
2.4.3. Комплексные соединения тиоцианатов
Тиоцианаты образуют комплексные соединения, в которых металл в зависимости от донорно-акцепторных свойств лиганд может координироваться как по атому N, так и по атому S. [9]
Hg(ΙΙ) образует тригональные комплексы тиоцианата ртути с пнитробензоилгидразином (L). Взаимодействием соответствующего Hg(SCN)2 c пнитробензоилгидразином и сплавлении при температуре 50-600 С были получены HgL(SCN)2 . Экспериментально установлено, что данное вещество не растворимо в большинстве органических растворителях, умеренно растворимы в MeCN, причем их растворы не являются электролитами. В спектре HgL(SCN)2 проявляются полосы C-N, C-S и C-S, что указывает на кольцевой характер группы SCN и ее координацию с Hg2+ через атом S. Исходя из того, что лиганд L монодентантен, а группа SCN кольцевая был сделан вывод, что нейтральный Hg(SCN)2 имеет мономерное трехкоординационное строение. [10]
2.4.4 Применение тиоцианатов
Тиоцианаты используют в промышленности. NH4 SCN используется в гальваностегии, в фотографии, при крашении и набивке тканей (в частности, для сохранения свойств шелковых тканей), для приготовления охладительных смесей, для получения цианидов и гексацианоферратов (II), тиомочевины, гуанидина, пластмасс, адгезивов, гербицидов.
NaSCN используется в фотографии, как протрава при крашении и набивке тканей, в медицине, как лабораторный реагент, в гальваностегии, для приготовления искусственного горчичного масла, в резиновой промышленности.
KSCN используется в текстильной промышленности, в органическом синтезе (например, для получения тиомочевины, искусственного горчичного масла или красителей), для получения тиоцианатов, охлаждающих смесей, инсектицидов.
Ca(SCN)2 *3H2 O применяется как протрава при крашении или набивке тканей и как растворитель для целлюлозы, для мерсеризации хлопка, в медицине вместо иодида калия (для лечения атеросклероза), для получения гексацианоферратов (II) или других тиоцианатов, при изготовлении пергамента.
CuSCN используется как протрава при набивке текстильных изделий, для изготовления красок ("marine paints") и в органическом синтезе; Cu(SCN)2 используется для приготовления детонирующих капсул и спичек. Они используются и в аналитической химии в качестве реагентов в роданометрии и меркуриметрии.[8]
Тиоцианатные комплексы используют в фотометрическом анализе для определения Со, Fe, Bi, Mo, W, Re, в технологии редких металлов для разделения Zr и Hf, Th и Ti, Ga и Аl, Та и Nb, Th и La, для получения спектрально чистого La. Тиоцианаты Nb(V) и Ta(V) являются катализаторами в реакции Фриделя – Крафтса. [9]