Курсовая работа: Тесты как инструмент измерения уровня знаний по теме: "Кислородсодержащие органические соединения с элементами экологии"
![]()
2. Реакции окисления (протекают легко):
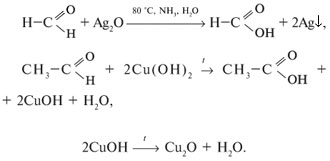
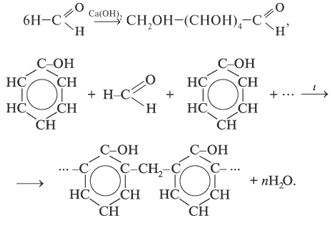
3. Реакции полимеризации и поликонденсации:
2.5 Одноосновные предельные карбоновые кислоты
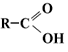
Строение молекул
Электронная и структурная формулы одноосновных карбоновых кислот следующие:
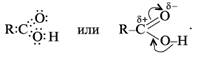
Из-за сдвига электронной плотности к атому кислорода в карбонильной группе атом углерода приобретает частичный положительный заряд. Вследствие этого углерод притягивает электронную плотность от гидроксильной группы, и атом водорода становится более подвижным, чем в молекулах спиртов.
Получение
В промышленности:
а) окислением алканов:
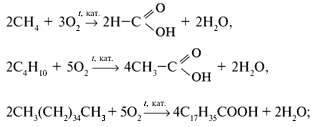
б) окислением спиртов:
![]()
в) окислением альдегидов:
![]()
г) специфическими методами:
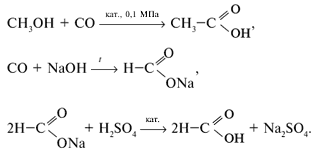
Химические свойства
1. Простейшие карбоновые кислоты в водном растворе диссоциируют:
СН3 СООН ![]() Н+ +СН3 СОО– .
Н+ +СН3 СОО– .
2. Реагируют с металлами:
2HCOOH + Mg ![]() (HCOO)2 Mg + H2
(HCOO)2 Mg + H2 ![]() .
.
3. Реагируют с основными оксидами и гидроксидами:
HCOOH + КОН ![]() НСООК+ Н2 О.
НСООК+ Н2 О.
4. Реагируют с солями более слабых и летучих кислот:
2СН3 СООН + К2 СО3 ![]() 2СН3 СООК + СО2
2СН3 СООК + СО2 ![]() + Н2 О.
+ Н2 О.
5. Некоторые кислоты образуют ангидриды:
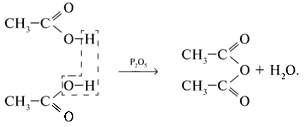
6. Реагируют со спиртами: