Курсовая работа: Цинк и его свойства
Рассчитаем РН среды.
![]()
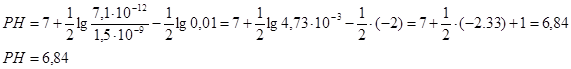
Повлиять на процесс гидролиза можно с помощью добавки реактивов, кислот или основ. В процессе гидролиза мы получаем ионы Н+ , если их связать действием ионов ОН- , то процесс гидролиза усилится. Поскольку гидролиз процесс равновесный, то уменьшение концентрации ионов Н+ из – за реакции:![]() приведет к смещению равновесия вправо, к усилению гидролиза.
приведет к смещению равновесия вправо, к усилению гидролиза.
Ослабить гидролиз можно введение ионов Н+ , что приведет к смещению равновесия влево.
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Zn и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Решение.
Цинк – сильный восстановитель. На реакции цинка и ионами меди основана работа химического элемента Даниеля. Нормальный электродный потенциал цинка - 0.7618 В . как восстановитель цинк используют в многих химических процессах, например, он используется при восстановлении органических веществ, и т.п.
Восстановительная активность цинка проявляется особенно активно при РН<7, в кислых растворах. Он восстанавливает водород из кислот, например разбавленной серной или соляной.
![]()

Также цинк может восстанавливать металлы менее активные чем он сам в нейтральной среде. Он восстанавливает металлы от хрома (-0,74 В) до серебра (0,79 В). Это его свойство часто используют для изготовления гальванических элементов.
![]()
В щелочной среде цинк окисляется до иона ![]() , он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
, он также может восстанавливать водород из воды, восстанавливает многие неорганические соли, кислородные соединения.
Нормальный электродный потенциал электрода равен для реакции: ![]() -1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
-1,216 В, это значит, что цинк может восстанавливать в щелочной среде все соединения с более положительным потенциалом, это будут кислородные соединения хрома, марганца, олова, свинца и т.п.
![]()
Приведенное выше уравнение будет примеров взаимодействия цинка в щелочной среде.
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7. 
Предварительно рассчитайте Е0 химической реакции, используя метод электронно-ионного баланса.
Решение.
Для указанных уравнений запишем окислительно-восстановительные уравнения реакций. Сначала рассмотрим эти уравнения и решим их с помощью электронного баланса.
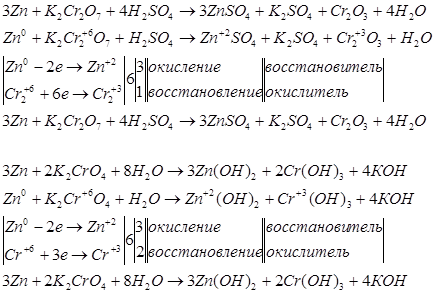
Запишем уравнения электронно-ионного баланса.
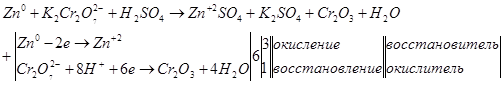
Суммируем уравнения.
![]()
Запишем полученное уравнение в молекулярном виде:
![]()
Рассчитаем Е0 химической реакции.
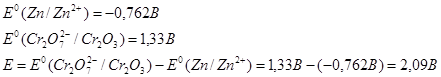
![]()

Суммируем уравнения.
![]()