Курсовая работа: Виды теплообмена
справедливая в интервале значений 20000<Reмакс <80000.
Падение давления (Н/м2 ) в потоке газа через пучок труб можно рассчитать по соотношению
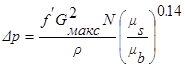 (2.10)
(2.10)
где G макc —массовая скорость при минимальной площади проходного сечения, кг/(с. м2 );
r—плотность при условиях в невозмущенном потоке, кг/м3 ;
N—число поперечных рядов.
Эмпирический коэффициент трения f’ определяется по рекомендованным формулам
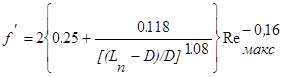 (2.11)
(2.11)
при шахматном расположении труб и
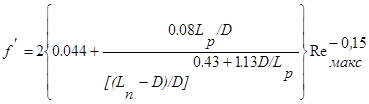 (2.12)
(2.12)
при коридорном расположения труб.
Для расчета коэффициента теплоотдачи при турбулентном обтекании пучка труб при наличии 10 и более рядов труб как при коридорном, так и шахматном их расположении и Reмакс >6000 рекомендуется формула
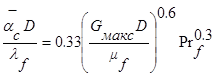 , (2.13)
, (2.13)
которая, с достаточной точностью описывает экспериментальные данные.
2.3 Расчёт теплофизических характеристик cмеси газов
В теплотехнике обычно приходится встречаться не с отдельными газами, а со смесями газов. Такие смеси часто получаются как продукт процесса горения, представляющий собой химический процесс соединения горючих элементов топлива (С, Н, S) с кислородом воздуха. Продукты полного сгорания топлива состоят из СО2 , SO2 , Н2 О, О2 ,N2 . При неполном сгорании в состав продуктов сгорания входят такие газы, как СО, СН4 , Н2 ,С2 Н2 и т. д. Смесь продуктов неполного сгорания топлива представляет собой газовую смесь, способную к дальнейшему сгоранию, и поэтому её применяют как горючий газ в печах, топках или камерах сгорания различных тепловых установок.
При рассмотрении газовых смесей исходят из того, что смесь идеальных газов, не вступающих в химическое взаимодействие друг с другом, также является идеальным газом и подчиняется всем законам, относящимся к идеальным газам. При этом каждый газ, входящий в состав газовой смеси, ведёт себя так, как будто он один при данной температуре занимает весь объём смеси. Давление, которое при этом оказывает каждый компонент смеси на стенки сосуда, называется парциальным давлением , а давление газовой смеси складывается из парциальных давлений газов, образующих газовую смесь. Это положение составляет содержание закона Дальтона для газовых смесей, который Дальтон установил опытным путём в 1807 г.
Математически этот закон записывается следующим образом:
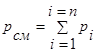 , (2.14)
, (2.14)
где рсм – давление смеси газов;
рi – парциальное давление i – го компонента, входящего в состав смеси;
n – число компонентов, образующих смесь.
Цель расчёта газовой смеси состоит обычно в определении молекулярной массы, газовой постоянной плотности удельного объёма и парциальных давлений компонентов, образующих смесь. Состав газовой смеси может быть задан двояко: массовыми или объёмными долями.
В первом случае, если обозначить массу смеси Gсм , а массу какого-то i – го компонента Gi , то отношение Gi к Gсм и определит массовую долю этого i – го компонента, обозначаемую через gi , т. е.
 , и
, и
 .
.
Во втором случае объём смеси и объём каждого компонента, входящего в смесь, одинаковы и по отдельности равны по объёму того сосуда, в котором помещена смесь газов. При этом температура смеси и температура каждого компонента также одинаковы, а давление разные, ибо каждый из компонентов находится под своим парциальным давлением, а вся смесь под давлением, равным сумме этих парциальных давлений. Для того, чтобы сравнить количество газов, входящих в смесь, по объёму, нужно объёмы компонентов привести к одинаковому давлению, в качестве которого выбирают обычно давление смеси. Объёмы компонентов, приведенные к давлению смеси, называются парциальными объёмами. Если объём смеси обозначить Vсм , а парциальный объём i – го компонента – Vi , то объёмную долю i – го компонента можно найти как отношение его парциального объёма к объёму смеси, т. е.  ( где ri – объёмная доля i – го компонента). Чтобы найти
( где ri – объёмная доля i – го компонента). Чтобы найти
 ,
,
нужно определить, чему равна сумма парциальных объёмов  . Поскольку температура смеси и всех компонентов одинакова, напишем уравнение Бойля – Мариотта для i – го компонента при двух состояниях: когда он занимает объём смеси и находится под парциальным давлением и когда он занимает парциальный объём и находится под давлением смеси, т. е.
. Поскольку температура смеси и всех компонентов одинакова, напишем уравнение Бойля – Мариотта для i – го компонента при двух состояниях: когда он занимает объём смеси и находится под парциальным давлением и когда он занимает парциальный объём и находится под давлением смеси, т. е.