Курсовая работа: Витамин С: структура, химические свойства, значение
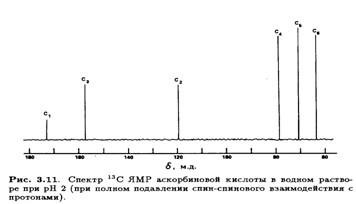
Неполное подавление спин-спинового взаимодействия с протонами приводит к ожидаемому расщеплению сигналов, т. е. С-1, С-2 и С-3 (синглеты), С-4 и С-5 (дуплеты) и С-6 (триплет). Сигналы С-4 и С-5 удалось дифференцировать после того, как был получен спектр при полном подавлении спин-спинового взаимодействия с протонами производного, дейтерированного по положению 4, где сигнал при 77δ м. д. стал триплетом вследствие спин-спинового взаимодействия с дейтерием. Сигнал С-3 был идентифицирован благодаря его большому (19δ м. д.) слабопольному сдвигу при изменении рН от 2 до 7, что приводит к депротонированию С-3—ОН. Особенно интересен спектр 1 Н ЯМР L-аскорбиновой кислоты, так как его тщательный анализ позволяет определить конформацию молекулы в водном растворе. При снятии спектра в D2O четыре протона ОН-групп замещаются на дейтерий и не проявляются в виде сигналов. Остальные четыре протона (Н-6, Н-6', Н-5 и Н-4) образуют систему АВМХ, причем протоны при С-6 неэквивалентны из-за хиральности атома С-5.
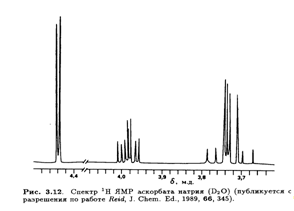
Тонкая структура этих сигналов не проявляется в низких магмагнитных полях (60 или 100 МГц), но выше 300 МГц обнаруживается спин-спиновое взаимодействие, не являющееся взаимодействием первого порядка. Это расщепление особенно заметно в спектре 1 Н ЯМР аскорбата натрия (рис. 3.12).
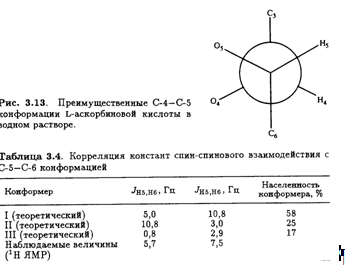
Значения констант спин-спинового взаимодействия J, полученные из таких спектров, позволяют определить преимущественную конформацию L-аскорбиновой кислоты в водном растворе. Например, найдено, что Jh4 ,H5 составляет 1,8 Гц. Это соответствует предсказанному значению для конформации, изображенной на рис. 3.13. Таким образом, преимущественная конформация вокруг связи С-4—С-5 в водном растворе такая же, как и в кристалле (рис. 3.8).
В равной степени информативна корреляция констант спин-спинового взаимодействия с конформацией вокруг связи С-5—С-6.
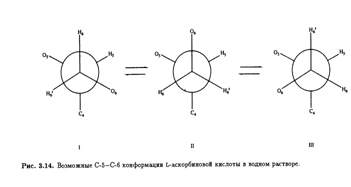
Возможные стабильные конформеры представлены на рис. 3.14. Предположив, что наблюдаемые константы спин-спинового взаимодействия являются весовым усреднением теоретических величин для трех конформеров, можно вычислить их населенность (табл. 3.4). И снова предпочтительная конформация вокруг связи С-5—С-6 в растворе идентична обнаруженной в кристалле. Сходство преимущественных конформации боковых цепей в кристаллической решетке и в растворе объясняется, возможно, отсутствием в обоих случаях внутримолекулярных водородных связей. Но, конечно, прочные межмолекулярные водородные связи образуются между соседними молекулами аскорбиновой кислоты в кристалле и с молекулами воды в водном окружении.
1.3.5Масс-спектрометрия
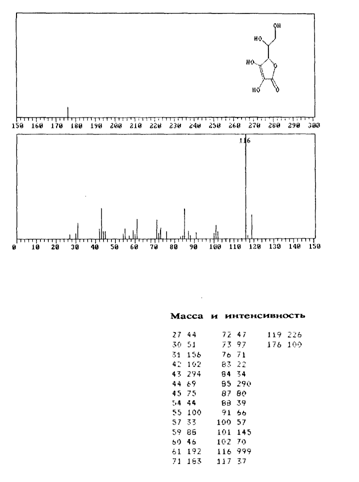
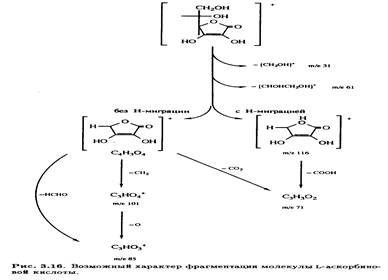
В масс-спектре L-аскорбиновой кислоты, зафиксированном при ионизации молекулы под действием электронного удара, имеется интенсивный пик с m /е 116 наряду с пиком молекулярного иона (m /е 176) (рис. 3.15). Было высказано предположение, что фрагментация происходит за счет отщепления боковой цепи с последующим разрушением кольца, что соответствует наличию наиболее интенсивных сигналов (рис. 3.16).

2 Химические свойства l -аскорбиновой кислоты
Некоторые превращения L-аскорбиновой кислоты уже упоминались в разделе, посвященном установлению структуры молекулы.
Эти и другие реакции будут подробно рассмотрены в последующих разделах.
2.1 Алкилирование и ацилирование
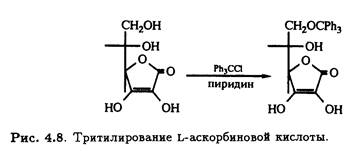
Как и у многих углеводов, первичный гидроксил при С-6 L-аскорбиновой кислоты легко подвергается трифенилметилированию (тритилированию) под действием трифенилхлорметана в пиридине (рис. 4.8).
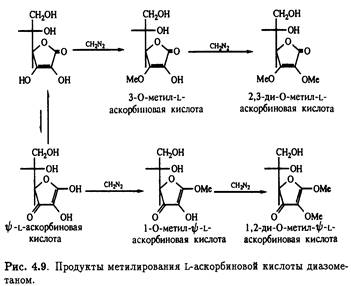
Метилирование L-аскорбиновой кислоты диазометаном проливает свет на таутомерную природу витамина. Повышенная кислотность гидроксила при С-3 позволяет оттитровать его диазометаном в эфире; при этом образуется
3-О-метиласкорбиновая кислота. Реакция сопровождается образованием небольших количеств 1-метил-ψ -L-аскорбиновой кислоты вследствие присутствия минорных количеств таутомера. Оба соединения подвергаются дальнейшему етилированию диазометаном,давая 2,3-ди-О-метил-L-аскорбиновую и 1,2-ди-O-метил- ψ -L-аскорбиновую кислоту соответственно (рис. 4.9)
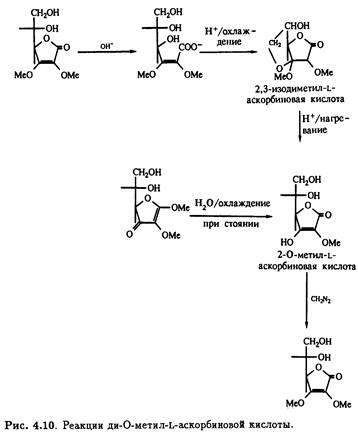
Под действием щелочи с последующим подкислением 2,3-ди-О-метильное производное претерпевает интересную цепь превращений. Образуется не простой моноциклический лактон, а бициклическое производное с единственным свободным гидроксилом — 2,3-изодиметил-L-аскорбиновая кислота. Кислотный гидролиз этого продукта приводит к 3-О-метил-L-аскорбиновой кислоте, которая также получается при стоянии на холоду водного раствора 1,2-ди-O-метил- ψ -L- аскорбиновой кислоты, что сопровождается потерей лабильного метильного остатка при С-1. Как и следовало ожидать, 3-O-метил-L-аскорбиновая кислота легко метилируется под действием диазометана в эфире, образуя 2,3-ди-О-метилированное производное. Описанные превращения суммированы на рис. .10.
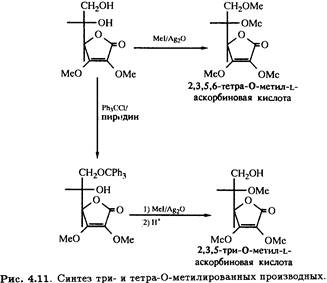
2,3-Ди-О-метил-L-аскорбиновая кислота может быть подвергнута дальнейшему метилированию иодметаном в присутствии оксида серебра с образованием 2,3,5,6-тетра-О-метилированного продукта, а также тритилированию первичной спиртовой группы при С-6. Метилирование с последующим снятием тритильной защитной группировки в кислой среде приводит к 2,3,5-три-О-метильному производному (рис. 4.11), которое, как было показано, участвует в цепи превращений, идентичных приведенным на рис. 4.10, и превращается в бициклическое 2,3,5-изотриметильное производное.
Катализируемая кислотами этерификация аскорбиновой кислоты, например ацетилирование, первоначально приводит к образованию О-6-ацильного производного, а в более жестких условиях — к 5,6-диэфиру. Кристаллический 5,6-диацетат хорошо известен; получение 2,3,4,6-тетраацетата требует еще более жестких условий.
В щелочных условиях электрофильная атака алкилирующих и ацилирующих агентов зависит от кислотности и стерической доступности гидроксильных групп при С-2, С-3, С-5 и С-6. Наиболее кислым является атом водорода гидроксила при С-3 (рКа = 4,25), но делокализация отрицательного заряда в соответствующем анионе снижает его реакционную способность и приводит к возникновению двойственной природы, которая выражается в том, что алкилироваться может не только положение О-3, но и положение С-2. В результате селективная модификация положения О-3 затруднена, и добиться ее можно только с помощью таких сильных алкилирующих и ацилирующих агентов, как диазометан и хлорангидриды.