Курсовая работа: Властивості оксихіноліну, сфери його використання
+ 2HCl = MeCl2 +
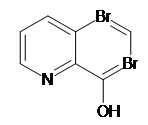
+ 2Br2 = +2HBr
Наприкінці титрування оксихіноліну бром взаємодіє з метиловим оранжевим, руйнуючи молекули останнього. Отже, забарвлення індикатора зникає і розчин набуває жовтого кольору. Від невеликого надлишку брому.
Колориметричне визначення металів у вигляді оксихінолінатів полягає в тому, що оксихінолінати розчиняють в органічних розчинниках і вимірюють інтенсивність забарвлення неводного розчину. [1]
8 - Оксихінолін майже універсальний комплексоутворювач, він взаємодіє з іонами багатьох металів, утворюючи нерозчинні у воді осади. Його застосовують для визначення алюмінію, беріллію, ванадію, вісмуту, вольфраму, галію, германію, кадмію, кобальту, лантану, літію, магнію, марганцю, міді, молібдену, нікелю, рутенію, сурми, титану, торію, урану, хрому, церію, свинцю, цинку, індію, талію і цирконію.
За виключенням комплексів алюмінію, вісмуту, галію, свинцю, індію і талію всі інші оксихіноляти мають у своєму складі кристалізаційну воду. Більша частина комплексів має стехіометричний склад (з кристалізаційною водою або без неї), і після просушування при відповідній температурі можна зважувати. Сушку проводять звичайно при температурі 100 – 1050 С і зважують комплекси з кристалізаційною водою, або сушать при температурі 130 – 1400 Сі зважують без кристалізаційної води.
Сильні кислоти руйнують комплекси з виділенням оксихіноліну, у кількості, еквівалентній металу, яку визначають броматометричним методом.
Електронейтральні оксихінолінові комплекси помірно розчинні у воді, вони легко розчиняються у неполярних розчинниках, що не змішуються з водою, наприклад, у хлороформі. Саме цьому цей ліганд застосовують для збагачення іонів металу шляхом екстракції розчинником з послідуючим спектрофотометричним визначенням. (Таблиця 1).
Таблиця 1
Застосування 8 – оксихіноліну для визначення металів комбінованим методом спектрофотометрії з екстракцією.
| Іон | рН середовища | Розчинник для екстракції | Мах поглинання, нм. | Іони, що заважають | Маскуючи реагенти, примітки |
| Al(III) | 4,5 - 11 | CHCl3 | 390 | Co, Ni, Zn, Cd, Fe (II) та ін. | CN- |
| Ba(II) | >10 | CHCl3 | 380 – 400 | Ті ж самі | Необхідна повторна екстракція у органічній фазі знайдено ВаА2 (АН)2 |
| Be(II) | 6 - 10 | CHCl3 | 380 | Ті ж самі | |
| Сe(III) | 9,9 – 10,6 | CHCl3 | 495 - 500 | Fe(III) | Необх. присутність цитрату або тар трату |
| Cu(II) | 2 - 12 | CHCl3 | 410 - 420 | CN- , ЕДТА | |
| Fe(III) | 2 - 10 | CHCl3 | 470, 580 | V(V), Ru(III), Ce(IV) | |
| Hg(II) | >3 | CHCl3 | 390 | ||
| In(III) | 3 – 11,5 | CHCl3 | 395 - 400 | Сильна флуоресценція | |
| U(VI) | 5 - 9 | CHCl3 | 425-430 | Зв’язуються ЕДТА | В органічній фазі UO2 A2 HA |
| V(V) | 2 - 6 | CHCl3 | 380, 580 | В органічній фазі VO2 A | |
| Zr(IV) | 1,5 – 4,0 | CHCl3 | 385 | В органічній фазі ZrOA2 |
Область оптимальних значень рН для утворення комплексів залежить від міцності оксихінолятів. (Таблиця 2)
Таблиця 2
Область рН кількісного осадження стехіометричгних комплексів металів з оксихіноліном
| Центральний атом | Область рН | Центральний атом | Область рН |
| Al(III) | 4,2 – 9,8 | Mn(II) | 5,9 – 9,5 |
| Cd(II) | 5,7 – 14,6 | Mo(VI) | 3,6 – 7,3 |
| Cu(II) | 2,7 – 14,6 | Pd(II) | 3,5 – 8,5 |
| Fe(III) | 2,8 – 11,2 | Sc(III) | 6,5 – 8,5 |
| Ga(III) | 3,6 – 11,0 | U(VI) | 5,7 – 9,8 |
| In(III) | 2,5 – 3,0 | W(VI) | 5,0 – 5,7 |
| Mg(II) | 9,6 – 12,7 | Zn(II) | 4,7 – 13,5 |
Двовалентні метали звичайно кількісно випадають у осад за умов нейтрального абослабо - лужного середовища. Потрібне значення рН підтримують різноманітними тартратними буферними розчинами. Наприклад, використовують розчин, аміак – тар трат амонію, для підтримування рН у межах 6 – 10. Або гідроксид натрію - тартрат натрію для рН у межах 10-13. Комплекси трьох и чотирьохвалентних металів більш стійкі, і їч можна осаджувати навіть при рН > 4. У цьому випадку рН підтримують буферним розчином складу оцтова кислота – оцтовокислий натрій. Комплекси міді (II) і заліза (II) осаджуються вже при рН = 2,7.
1.2 Приготування розчину 8 – оксихіноліну
За звичай використовують 2 – 4% розчин оксихіноліну у етиловому спирті або ацетоні. Розчин готують перед визначенням, його можна зберігати не більше як 8 – 10 днів, тому що реагент розкладається. У тих випадках коли присутність спирту або ацетону значно підвищує розчинність утворюванного комплексу, застосовують розчин ацетату оксихіноліну. Для цього 3 – 4 г оксихіноліну розчиняють у декількох мілілітрах льодяної оцтової кислоти і розводять розчин дистильованою водою до 100мл. Розчин нейтралізують концентрованим розчином аміаку, до появи білої каламуті, далі по краплях додають 2 мл концентрованої оцтової кислоти доти, доки розчин не стане прозорим. Цей розчин можна зберігати тривалий час без розкладання.
1.3 Загальні правила методик визначення з оксихіноліном
Для визначення іонів різних металів у вигляді оксихінолінатів розроблені різноманітні гравіметричні, титрометричні, спектрофотометричні методики. При визначенні іонів окремих металів методики дещо відрізняються у залежності від фізико – хімічних властивостей комплексів. При створенні методик дотримуються загальних правил:
1. Для кількісного утворення комплексу необхідний надлишок реагенту. У кислих середовищах, що містять оцтову кислоту, поява жовтого забарвлення, а у лужних середовищах – поява помаранчевого забарвлення, слугує вказівкою на надлишок реагенту. Але з за малої розчинності реагенту у воді, його надлишок не повинний бути великим, саме з цих причин при осадженні треба уважно слідкувати за зміною забарвлення.
2. Кристалізація комплексу проходить краще, якщо суміш нагріти до 60 – 700 С і гріти на протязі 3 – 5 хвилин.
3. Найчастіше осад відфільтровують при високій температурі. При охолодженні фільтрату може випадати осад, але при нагріванні він знову розчиняється. Якщо осад у фільтрі не розчиняється при нагріванні, це свідчить про те, що осад – комплекс металу з оксихіноліном, і в такому випадку осадження слід повторити з надлишком реагенту.
4. Осад збирають на фільтрі і промивають гарячою дистильованою водою, до зникнення забарвлення реагенту.
5. Коли застосовують гравіметричні методи аналізу, осад за звичай сушать при температурі 130 – 1400 С. Після просушування утворюється безводний комплекс, як що з початку осад мав у складі кристалізаційну воду.
6. Комплекси з оксихіноліном кількісно розчиняються у 10% - вій соляній кислоті. Оксихінолін, що при цьому перейшов у розчин, еквівалентний кількості визначуваного металу. Його можна від титрувати броматометричним методом. І відповідно знайти вміст металу у пробі.
7. Комплекси дають дуже сильно забарвлені розчини у хлороформі, це дозволяє визначити багато йонів металів спектрофотометричним методом.
8. Деякі оксихіноляти металів, наприклад, алюмінію, галію, індію, цинку, сильно флуоресціюють у розчині хлороформу. Ця властивість може слугувати для визначення металів флуориметричним методом. [4]
В аналітичній хімії, оксихінолін використовують дуже часто, як у якісному аналізі (в основному – як реактив на магній) [13], так і в кількісному аналізі. Далі розглянуто методики кількісного визначення речовин у вигляді оксихінолінатів.
2. АНАЛІТИЧНІ МЕТОДИ ВИЗНАЧЕННЯ МЕТАЛІВ ЗА ДОПОМОГОЮ ОКСИХІНОЛІНУ