Курсовая работа: Властивості оксихіноліну, сфери його використання
ВСТУП
У аналітичній практиці для визначення металів використовують дуже багато реагентів. Велику групу серед них займають і органічні реагенти. Одним з таких є 8-оксихінолін. Цей органічний реактив використовується не тільки в хімічній науці, а ще й дуже поширений в медицині, як лікувальний засіб, особливо його галогенопохідні. Він використовується як у якісному так і у кількісному аналізах. Він є універсальним комплексоутворювачем і утворює комплекси з багатьма металами.
Вивчити властивості оксихіноліну і хімію взаємодії оксихіноліну з металами, встановити найбільш оптимальні і точні методи визначення металів за допомогою оксихіноліну є метою даної курсової роботи.
Визначення металів у зразках є дуже актуальним питанням, і тому застосування оксихіноліну для їх визначення є дуже доречним і доцільним.
Отже у даній курсовій роботі розглядатимуться властивості оксихіноліну по його відношенню до металів – утворюванню комплексів – оксихінолятів.
ОГЛЯД ЛІТЕРАТУРИ
1.ЗАГАЛЬНА ХАРАКТЕРИСТИКА ОКСИХІНОЛІНУ. ОКСИХІНОЛІН ЯК КОМПЛЕКСОУТВОРВАЧ
1.1 Загальні відомості
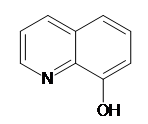 8
8
– Оксихінолін являє собою жовтувато – білі кристали або кристалічний порошок з характерним запахом. Він
практично не розчиняється у воді і ефірі, але добре розчиняється у спирті, ацетоні, хлороформі, бензолі,
оцтовій кислоті та в розведених розчинах мінеральних
кислот і основ. 8 - Оксихінолін має амфотерні властивості:
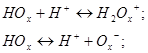
К осн = ![]()
К кисл = ![]()
![]()
Температура плавлення 8 – Оксихіноліну складає 74-760 С, температура кипіння – 2670 С.
Для аналітичних цілей приготовляють розчин 8 – оксихіноліну в оцтовій кислоті. [1]
Функціонально – аналітичну групу можна зобразити так:
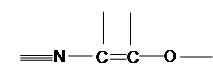 [12]
[12]
У молекулі оксихіноліну два реакційних центри: гідроксильна група – ОН є солеутворюючою, а група – Nє комплексоутворюючою.[2]
8 – оксихінолін взаємодіє з більшістю катіонів, утворюючи важкорозчинні сполуки:
При осадженні іонів атом водню оксігрупа витісняється еквівалентом металу, а азот з’єднується з металом координаційним зв’язком (вільна електронна пара).[3] Змінюючи рН розчину, оксихіноліном можна осадити іони одних металів у присутності інших.
За допомогою оксихіноліну метали визначають гравіметричним, титрометричним і колориметричним методами аналізу. При гравіметричному визначенні оксихінолінати металів висушують і зважують або прожарюють і зважують у вигляді оксидів.
У титрометричному аналізі визначення ґрунтується на тому, що осаджений і відфільтрований оксихінолінат металу розчиняють у соляній кислоті, а оксихінолін, який при цьому утворюється, відтитровують броматом калію у присутності броміду калію і метилового оранжевого.
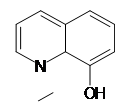
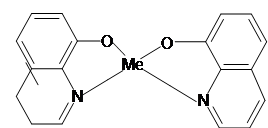
MeCl2 +2 +2NH4 OH = +
+Me + 2NH4 Cl + 2H2 O
--> ЧИТАТЬ ПОЛНОСТЬЮ <--