Курсовая работа: Водородная связь
Повышение температуры кипения спиртов происходит также вследствие укрупнения их молекул. Водородная связь характерна и для многих других органических соединений (фенолов, карбоновых кислот и др.). Из курсов органической химии и общей биологии известно, что наличием водородной связи объясняется вторичная структура белков, строение двойной спирали ДНК, т. е. явление комплементарности.
3. Виды водородной связи
Существует два вида водородной связи внутримолекулярная и межмолекулярная водородные связи. Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений. Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
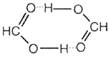
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
4. Энергия водородной связи
Существуют несколько подходов к характеристике водородных связей. Основной критерий – это энергия водородного связывания (R–X–H… B–Y), которая зависит как от природы атомов Х и В, так и общего строения молекул RXH и BY. Большей частью она составляет 10–30 кДж/моль, но в некоторых случаях может достигать 60–80 кДж/моль и даже выше. По энергетическим характеристикам различают сильные и слабые водородные связи. Энергия образования сильных водородных связей составляет 15–20 кДж/моль и более. К ним относят связи О–H… О в воде, спиртах, карбоновых кислотах, связи О–Н… N, N–H… O и N–H… N в соединениях, содержащих гидроксильные, амидные и аминные группы, например в белках. Слабые водородные связи имеют энергию образования менее 15 кДж/моль. Нижним пределом энергии водородной связи является 4–6 кДж/моль, например связи С–Н… О в кетонах, эфирах, водных растворах органических соединений.
Наиболее прочные водородные связи образуются в случаях, когда маленький водород (жесткая кислота) одновременно связан с двумя малыми по размеру сильно электроотрицательными атомами (жесткие основания). Орбитальное соответствие обеспечивает лучшее кислотно-основное взаимодействие и приводит к образованию более прочных водородных связей. То есть образование сильных и слабых водородных связей можно объяснить с позиций концепции жестких и мягких кислот и оснований (принцип Пирсона, принцип ЖМКО).
Энергия Н-связи возрастает с увеличением положительного заряда на атоме водорода связи Х-Н и с повышением протоноакцепторности атома В (его основности). Хотя образование водородной связи рассматривается с позиций кислотно-основного взаимодействия, однако энергия образования Н-комплексов нестрого коррелируется как со шкалой кислотности, так и со шкалой основности.
Подобная картина наблюдается и в случае меркаптанов и спиртов. Меркаптаны являются более сильными кислотами, чем спирты, однако более прочные ассоциаты образуют спирты. Причина таких кажущихся аномалий вполне объяснима, если учесть, что кислотность определятся величиной pКа по результатам полной схемы кислотно-основного взаимодействия (до образования сольватированных ионов), а образование молекулярного комплекса с Н-связью только первый этап этого процесса, не предусматривающий разрыва связи Х–Н. В инертных растворителях кислотно-основное взаимодействие обычно останавливается на стадии Н-комплекса.
Что касается основности органических соединений и их способности принимать участие в образовании Н-связи, то здесь тоже наблюдаются большие различия. Так, при одной и той же способности к образованию водородных связей степень основности аминов на 5 порядков выше, чем у пиридинов, и на 13 порядков выше, чем у замещенных карбонильных соединений.
На основе экспериментальных данных установлена линейная корреляция между степенью переноса заряда и энергией межмолекулярных Н-связей, являющаяся важным доводом в пользу донорно-акцепторной природы последних. Существенное влияние на образование водородной связи могут оказывать стерические факторы. Например, орто-замещенные фенолы менее склонны к самоассоциации, чем соответствующие мета- и пара-изомеры, полностью отсутствует ассоциация у 2,6-ди-трет .-бутилфенола. С повышением температуры количество молекулярных комплексов в смеси уменьшается, и они значительно реже встречаются в газовой фазе.
В начале курсовой было отмечено, что водородная связь занимает промежуточное положение между истинной (валентной) химической связью и слабым межмолекулярным взаимодействием. Куда ближе? Ответ неоднозначный, так как диапазон колебаний энергий Н-связей довольно широк. Если же речь идет о сильных водородных связях, способных оказывать существенное влияние на свойства веществ, то они ближе к истинным химическим связям. И это определяется не только довольно высокой энергией Н-связи, но и тем, что она локализована в пространстве, водородный мостик имеет своих “персональных” партнеров. Направление действия водородной связи также фиксировано, хотя и не столь жестко, как для истинных химических связей.
5. Водородные связи с свойства органических соединений
Водородная связь возникает при взаимодействии кислотных Х–Н и основных В групп, принадлежащих одной или разным молекулам. При объединении одинаковых молекул образуются ассоциаты, объединение разных молекул принято называть молекулярными комплексами (Н-комплексами). Такие взаимодействия составляют самый обширный класс Н-связей, называемых межмолекулярными водородными связями. Межмолекулярные взаимодействия не ограничиваются образованием бинарных комплексов, а могут приводить к структурам со множественными связями (вода, фтористый водород, спирты, фенолы, амиды, полипептиды, белки). Межмолекулярные водородные связи могут приводить к образованию цепей, колец или пространственных сеток. Аналогичные образования сохраняются и в кристаллах.
Если Н-связывание наступает в результате взаимодействия кислотного и основного фрагментов внутри одной молекулы, то образующиеся связи называют внутримолекулярными. Соединения с такими связями составляют другую большую группу соединений с водородной связью. Естественно, что образование внутримолекулярных водородных связей возможно, если структура молекулы допускает пространственное сближение фрагментов Х–Н и В до длины водородной связи. Возможность образования внутримолекулярной водородной связи не является препятствием для образования и межмолекулярных водородных связей. В качестве примера рассмотрим изомерные орто- и парагидроксибензальдегиды. Салициловый альдегид (орто-изомер) способен к образованию как внутри-, так и межмолекулярных водородных связей, тогда как для пара-изомера положение взаимодействующих групп допускает образование только межмолекулярных водородных связей


Экспериментально довольно легко отличить внутримолекулярную водородную связь от межмолекулярной. Если спектрально фиксируется образование Н-связей, а признаков ассоциации нет, это верное указание на внутримолекулярный характер водородной связи. Кроме того, межмолекулярная Н-связь (и ее спектральное проявление) исчезает при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется.
Водородные связи влияют на перераспределение электронной плотности в молекулах, что не может не отразиться на свойствах веществ. В случае слабых водородных связей изменение электронной плотности протекает в основном в пределах фрагмента Х–Н… В. С увеличением энергии водородной связи перераспределение электронной плотности затрагивает все атомы молекул, входящих в молекулярный комплекс, что в конечном итоге приводит к глубоким изменениям физических и химических свойств веществ. На свойства органических соединений оказывают значительное влияние как внутри-, так и межмолекулярные водородные связи. Влияние последних, особенно на физические свойства, является более существенным, так как межмолекулярные взаимодействия приводят к увеличению молекулярной массы со всеми вытекающими последствиями.
Теперь попытаемся ориентировочно оценить, насколько широко представлены водородные связи в органической химии. Все органические соединения за самым редким исключением содержат водород, то есть являются кислотами Бренстеда, а наиболее часто входящие в их состав элементы-органогены (O, N, S, галогены) содержат неподеленные пары электронов и могут выступать в качестве основных центров. Учитывая отмеченное, можно сказать, что большинство органических соединений потенциально способно к образованию водородных связей. По структурной формуле (природа взаимодействующих групп и их взаимное расположение) можно предсказать силу водородных связей и их характер (внутри- или межмолекулярные). При оценке взаимного влияния атомов в молекулах обязательно учитываются возможность образования водородных связей и их последующее влияние на скорость, механизм и направление реакций. Оценить влияние среды (растворителя) на ход химического процесса часто становится возможным лишь с учетом образования водородных связей. Таким образом, подготовка грамотного химика невозможна без овладения всем комплексом вопросов, связанных с водородной связью.
Рассмотрим несколько наиболее характерных примеров влияния водородных связей на свойства органических соединений. Прежде всего это так называемые прототропные процессы – превращения, связанные с переносом протона. Известно, что енольные структуры (гидроксильная группа находится при углероде с кратной связью =С–ОН) являются неустойчивыми и в органической химии часто такие формулы берут в квадратные скобки как указание на их нереальность, гипотетичность. В то же время β-дикетоны и другие 1,3-дикарбонильные соединения способны существовать в двух формах: кетонной и енольной. Для ацетоуксусного эфира эти превращения могут быть представлены схемой

Образование энергетически менее выгодной енольной формы объясняется как формированием системы сопряженных связей С=С–С=О, что всегда является стабилизирующим фактором, так и тем обстоятельством, что между енольным гидроксилом и карбонильным кислородом образуется внутримолекулярная водородная связь, понижающая свободную энергию енольной формы как путем “закрепления” атома водорода у более электроотрицательного элемента, так и в результате удлинения цепи сопряжения (Н-связь включена в круговую цепь сопряжения). С учетом водородных связей не только объясняют реальность енольной структуры, но и количество этой формы в таутомерной системе. На состояние кето-енольного равновесия большое влияние оказывает природа растворителя. Максимальное количество енольной формы отмечается в нейтральных неполярных растворителях (углеводороды). В водных растворах количество енольной формы незначительно, так как вода конкурентно образует с карбонильным кислородом межмолекулярные водородные связи, разрушая стабилизирующие енольную форму внутримолекулярные водородные связи.
Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K 1 ) аномально велика, а вторая (K 2 ) аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила:

Для карбоновых кислот характерно образование Н-комплексов и ассоциатов псевдоциклической структуры:

Межмолекулярные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии димерные структуры частично сохраняются. Кстати, образование димера карбоновой кислоты помогает дать ответ на давний вопрос, что в большей степени определяет прочность водородной связи – кислотность группы Х–Н или основность фрагмента В. Уксусная кислота (pKa = 4,7) по кислотности на несколько порядков уступая трихлоруксусной (pKa = 0,6), тем не менее образует более прочный димер. Основность протоноакцептора имеет приоритет перед кислотностью протонодонора.
Известно, что геминальные дигидроксипроизводные являются нестабильными соединениями – дегидратируясь легко превращаются в соответствующие альдегиды или кетоны. Хлоральгидрат является одним из немногих примеров, когда структура гем- диола является стабильной. И причину этого объясняют как сильным отрицательным индукционным эффектом (-I-эффект) трихлорметильной группы, так и наличием внутримолекулярных Н-связей:

Не имея возможности остановиться на других примерах влияния водородной связи на свойства органических соединений, приведем таблицу сравнительных характеристик проявления меж- и внутримолекулярных Н-связей (табл. 1 (по [1])).
