Отчет по практике: Электрический ток в жидких проводниках
Разумеется, если у вас есть готовый хромат натрия, готовить его излишне. Небольшой предмет, который вы собираетесь хромировать, обработайте как обычно наждачной бумагой, обезжирьте, протравите слабым раствором кислоты и промойте. Он будет катодом, подсоедините его к отрицательному полюсу источника тока. Анод нужен инертный, например, графитовый. Разберите старую батарейку и извлеките из нее графитовый стержень. Чтобы получить ток, достаточный для хромирования, надо взять аккумулятор либо несколько батареек для карманного фонаря.
Время опыта и требуемый ток подберите самостоятельно. По окончании электролиза выньте деталь из электролита, тщательно промойте ее и отполируйте до блеска тряпочкой с зубным порошком.
Урок гальванопластики.
Еще один очень распространенный электрохимический процесс – гальванопластика, т.е. осаждение толстого, массивного слоя металла на поверхности какого-либо предмета, форму которого хотят воспроизвести, скопировать. Гальванопластику используют в тех случаях, когда у металлической детали очень сложная форма и обычными способами (литьем или механической обработкой) ее трудно или невозможно изготовить. Так воспроизводят иногда скульптуры по моделям (колесница Аполлона на фронтоне Большого театра сделана гальванопластикой); так же кодируют с записи-эталона металлические формы, в которых прессуют грампластинки, в точности воспроизводя тончайший рельеф бороздок.
Если у вас не осталось раствора для меднения, то приготовьте его вновь. Возьмите кусок воска или парафина, очень тщательно разгладьте его поверхность, чтобы она стала по возможности плоской. На этом гладком участке процарапайте надпись, рисунок или узор. Советуем написать свои инициалы - тогда у вас получится монограмма. Писать удобнее всего иглой, только, пожалуйста, не оставляйте слишком глубоких царапин. Мягкой кисточкой нанесите на поверхность с рисунком электропроводящий порошок. Можно, например, растолочь в ступке грифель простого карандаша или графитовый стержень батарейки. По краям рисунка прижмите к поверхности, покрытой графитом, тонкие оголенные медные проволочки (они будут служить токоотводами) и соедините их между собой. Восковой слепок подвесьте в стакан, налейте электролит, опустите медный электрод и соберите такую же схему, как и в опытах с меднением. Но в отличие от гальваностегии тут нужен намного меньший ток, примерно 5-10 мА. Поэтому придется передвинуть движок реостата или же подобрать другое радиосопротивление. Включите ток и наберитесь терпения, потому что при таком токе медь будет осаждаться на графитированной поверхности по меньшей мере пять часов, если не больше, однако увеличивать ток не надо: качество работы будет гораздо хуже. Разомкните цепь и выньте из стакана восковой слепок. Осторожно опустите воск в горячую воду – он расплавится. А у вас в руках окажется тонкий медный листок с узором.
Аккуратно оторвите от него проволочки-токоотводы. Точная копия рисунка получена. Теперь можно перейти к весьма полезному делу: к изготовлению способом гальванопластики уникальных значков. Они будут только в вашей коллекции! Если же в кружке вы сделаете двадцать-тридцать сувениров, они долго будут напоминать вам и вашим товарищам о туристическом походе, о спортивных соревнованиях. Советов художественного свойства давать не будем: эскиз придумайте сами. Не надо сложных значков: и делать труднее, и смотрятся они хуже. По эскизу вырежьте шаблон из тонкого картона - он должен повторять внешний контур значка. Положите шаблон на тонкую медную или латунную фольгу и аккуратно вырежьте по нему столько заготовок, сколько значков вы собираетесь сделать. Ваша заготовка мягкая. Чтобы она стала жесткой, покройте ее слоем меди в гальванической ванне. В принципе вы уже умеете это делать; здесь вы найдете советы применительно к изготовлению значков. Заготовки проткните у края иглой и пропустите в отверстие тонкую медную проволочку. Промойте заготовки, протрите бензином и зубным порошком, еще раз промойте и, держа за подвеску или с помощью пинцета, опустите на полминуты в разбавленный, примерно 5%-ный раствор азотной кислоты. Напоследок промойте в проточной воде и подвесьте на металлический стержень. Всю подвеску опустите в стакан с двумя медными пластинками-анодами (значки будут катодами). Листочки фольги должны быть расположены на разных уровнях, чтобы они не закрывали друг друга. В стакан налейте электролит - 25 г медного купороса и 1,5 мл серной кислоты на 100 мл воды, желательно дистиллированной. Источник тока - аккумулятор; можно использовать и трансформатор с выпрямителем. Ток в цепи около 10 мА на 1 см2 . Толщина медного слоя должна быть 0,5-0,8 мм. Когда меднение закончено, промойте детали. Если вы решили сделать на значке рельефное изображение или надписи, наметьте их иглой. Ту часть поверхности, которую покрывать не надо, закройте тонким слоем клея БФ, лака или парафина, опустите заготовки в электролит и опять включите ток, чтобы открытые участки покрылись слоем меди - тогда они станут выпуклыми. После этого клей или парафин снимите. Если сумеете, выгравируйте на значке надпись или изображение, и обязательно припаяйте с обратной стороны булавку. Наконец, придадим значку нарядный вид. Химическая окраска и никелирование вполне пригодны. Но еще лучше выглядят значки "под старое серебро". Заготовьте 2-3%-ный раствор нитрата серебра (можно растворить в воде аптечный ляписный карандаш). Небольшими порциями добавляйте соляную кислоту - три-четыре объема на один объем раствора.
С выпавшего осадка хлорида серебра слейте раствор, осадок несколько раз промойте дистиллированной водой, сливая воду очень аккуратно, по стеклянной палочке, чтобы не терять хлорид серебра. К отмытому осадку добавьте небольшими порциями 30%-ный раствор иодида калия до тех пор, пока осадок не растворится полностью. Долейте воду, чтобы довести объем раствора до первоначального. У вас должно быть столько же электролита для серебрения, сколько вы приготовили его для меднения. В этот электролит погрузите значки (они вновь будут катодами). Анодами могут служить графитовые стержни, лучше из батареек, а не из карандашей, потому что их площадь должна быть немного больше площади значков. Плотность тока небольшая, около 1 мА/см2 . Так на значках образуется слой серебра и, конечно, оно выглядит как новое. Однако не такая уж хитрость почернить значки под старое серебро... Водный раствор сульфида калия примерно 0,5-1%-ной концентрации нагрейте до 50o С. Значки в этом растворе постепенно изменят цвет - они станут сначала серыми, потом синеватыми и, наконец, черными. Промойте значки и потрите их фетром или суконкой. Тогда выпуклые части посветлеют, остальная же поверхность останется черной, и значки будут выглядеть именно так, как изделия из старого серебра.
Экологическая составляющая
Гальваническое производство является одним из наиболее опасных источников загрязнения окружающей среды, главным образом поверхностных и подземных вод. Ввиду образования большого объёма сточных вод, содержащие вредные примеси тяжёлых металлов, неорганических кислот и щелочей, поверхностно-активных веществ и других высокотоксичных соединений, а также большого количества твёрдых отходов, особенно от реагентного способа обезвреживания сточных вод.
Экологическая опасность гальванического производства характеризуется объёмом потребляемой и сбрасываемой воды. Поэтому усилия по снижению экологической опасности должны быть направлены на проведение мероприятий, снижающих объём и токсичность образующихся отходов.
На предприятии сточные воды после гальванического производства проходят очистку на станции нейтрализации, где обезвреживаются и после нейтрализации сбрасываются на городские очистные сооружения на дополнительную очистку.
Выводы
На основе изученного нами обширного материала и собственных исследований можно сделать вывод, что электрический ток в жидких проводниках – важнейшее открытие в истории человечества, которое находит свое применение в разных средах: биологии, медицине, химии, промышленном производстве и т. д. Без этого процесса невозможно было бы получить некоторые чистые металлы, произвести обработку изделий, создать великолепные памятники (гальванопластика), ювелирные украшения и многое другое. Велико значение электролиза в получении тяжелой воды для ядерных реакторов. Применение этого процесса можно перечислять бесконечно, т. к. со временем оно становится еще более незаменимым, быстро расширяет свои границы.
Литература
1. Гальвани А., Вольта А. «Избранные работы о животном электричестве.» - М.; Л.: ОГИЗ, 1937.
2. Розенбергер Ф. «История физики.» - М.; Л.: ОНТИ, 1937.
3. Большая советская энциклопедия. В 30 тт.
4. Кудрявцев П.С. Курс истории физики. М. : Просвещение, 1982.
5. О. Ф. Кабардин, В. А. Орлов «Физика 10 класс» - М.: Просвещение, 1995.
6. Кириллова И. Г. «Книга для чтения по физике» - М.: Просвещение, 1986.
7. Интернет: http://galvan.ru/.
Приложение 1
Процесс электролиза в растворах и расплавах электролитов
Электрический ток в металлах никакими химическими процессами не сопровождается. Это объясняется тем, что носителями тока в металлах являются электроны. Но существует такой класс проводников, в которых электрический ток всегда сопровождается определенными химическими изменениями: растворы солей, кислот и оснований, т. е. растворы электролитов, а также их расплавы.
Соединим с источником тока последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены угольные электроды. Химически чистая вода почти не проводит электрического тока. Замкнув цепь, мы увидим, что лампа не горит. Однако если мы растворим в воде какую-нибудь соль, например медный купорос, то лампа загорится, а на катоде из раствора выделится медь.
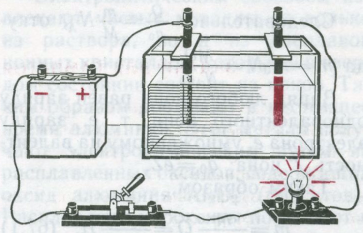
При протекании электрического тока через растворы электролитов вместе с зарядом всегда переносится вещество (это явление называется электролизом). Отсюда следует, что носителями тока в этих проводниках являются заряженные атомы, или группы атомов, т. е. ионы. При растворении в воде солей, кислот и щелочей нейтральные молекулы этих веществ расщепляются на положительные и отрицательные ионы. Это явление называется электролитической диссоциацией.
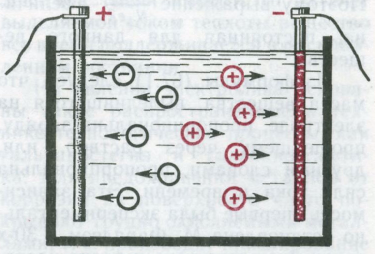
Растворы электролитов всегда содержат некоторое число ионов: катионов (положительных ионов) и анионов (отрицательных ионов). Пока электрическое поле отсутствует, ионы совершают только беспорядочное тепловое движение. Но в электрическом поле ионы, подобно электронам в металлах, начинают дрейфовать в направлении действующей на них силы: катионы — к катоду, анионы — к аноду.
Электрический ток в растворах (или расплавах) электролитов представляет собой перемещение ионов обоих знаков в противоположных направлениях.
Приложение 2
Краткая биография Луиджи Гальвани
Итальянский анатом и физиолог Луиджи Гальвани, один из основателей учения об электричестве, основоположник электрофизиологии, родился в Болонье. В 1759 г. окончил Болонский университет, в котором изучал сначала богословие, а затем медицину, физиологию и анатомию; в 1762 г. получил степень доктора медицины. Преподавал медицину в Болонском университете, откуда незадолго до смерти был уволен за то, что отказался принести присягу Цизальпинской республике, основанной в 1797 г. Наполеоном Бонапартом.