Реферат: Адсорбция на границе раздела фаз жидкость газ
Зависимость величины адсорбции описывается уравнением Ленгмюра:
![]() (15)
(15)
где Г ¥ — предельная адсорбция или величина адсорбции при полном насыщении поверхности мономолекулярным слоем адсорбтива; k — константа адсорбционного равновесия.
Определение характеристик поверхностного слоя . Величины постоянных уравнения Ленгмюра Г ¥ и k находят графическим методом. Уравнение (15) преобразуют к линейному виду:
![]() (16)
(16)
где ![]() .
.
Строят график зависимости c/Г от c .
Из уравнения (16) следует, что ![]() или
или
![]() (17)
(17)
![]() (18)
(18)
Величину Г¥ можно найти также, используя эмпирическое уравнение Шишковского:
![]() (19)
(19)
где s0 — поверхностное натяжение чистой жидкости, А и В — постоянные.
Постоянная В уравнения (19) связана с Г ¥ соотношением:
![]() (20)
(20)
Для известного значения s1 и В по уравнению (19) можно рассчитать постоянную А уравнения Шишковского и убедиться, что А равна константе k уравнения Ленгмюра.
Вычисление d и q . Установим формулы для расчета высоты адсорбционного слоя d и площади, занимаемой одной молекулой ПАВ на поверхности раствора q (см. рис.2).
![]()
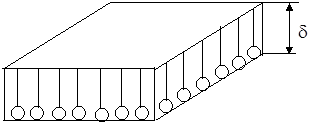
Рис.2. Схема расположения молекул ПАВ в поверхностном слое толщиной d.
При насыщении адсорбционного слоя молекулы ПАВ располагаются вертикально, причем полярные группы находятся в растворе, а неполярные группы атомов (радикалы) — в воздухе. На площади S =1м2 поверхности находятся Г ¥ поверхностно-активного вещества моль/м2 или Г ¥ ×М в кг/м2 , где М — молярная масса вещества (кг). С другой стороны в объеме S × d находится S × d × r кг вещества, где r — плотность вещества в кг/м3 или d × r в кг/м2 , тогда Г ¥ ×М = d × r или
![]() (22)
(22)
Число молекул ПАВ на 1м2 равно Г ¥ × NА , где NА — число Авогадро. Следовательно, площадь, занимаемая одной молекулой, равна:
![]() (23)
(23)
Сопоставляя вычисленное значение толщины слоя с длиной молекулы, известной из ее строения, можно сделать вывод об ориентации молекул ПАВ в адсорбционном слое.
Порядок выполнения работы:
Определение поверхностного натяжения растворов ПАВ проводят методом наибольшего давления газовых пузырьков. Работа по этому методу проводим в приборе, сконструированном П. А. Ребиндером (рис.3).

Сосуд (1) с исследуемой жидкостью (20-50мл) соединяется с водяным манометром (2) и делительной воронкой (3), которая служит для создания небольшого разряжения в системе. Сосуд (4) используется как буферная емкость. Разрежение в системе обеспечивается с помощью медленного вытекания воды из делительной воронки (3) в химический стакан. Сосуд плотно закрывается резиновой пробкой, через которую проходит стеклянная трубка (5), заканчивающаяся капилляром.
Капиллярный кончик должен иметь ровные острые края. Очень удобны кончики, изготовленные из толстого стекла, с пипеткообразным расширением, предшествующим капилляру.
Очистка капиллярного кончика производится засасыванием в него хромовой смеси с помощью груши и последующей промывкой дистиллированной водой. При опыте капиллярный кончик погружен в жидкость, но так, чтобы он только касался ее поверхности, слегка приподнимая жидкость (рис.1.).
Опыт начинаем с определения Р max для дистиллированной воды. Открываем кран 6. Внутри сосуда 1 создается разряжение и через жидкость начинают проскакивать пузырьки воздуха. Скорость образования пузырьков регулируем краном 6 так, чтобы время образования было не менее 10-20 сек., в течение этого времени на поверхности пузырька успевает установиться адсорбционное равновесие. При определении поверхностного натяжения на границе жидкости, содержащей ПАВ, необходимо, чтобы время образования пузырька было не менее 30 сек. В момент проскакивания пузырьков замечаем разность уровней жидкости в манометре (2). Разность уровней жидкости в манометре D h = h2 - h1 , где h2 — уровень жидкости в левом колене манометра;h1 — в правом, соответствует максимальному давлению, необходимому для образования пузырька Р max . Изменяем положение крана 6 и повторяем измерение Р max 3-4 раза и берем среднее значение D h (колебания отдельных наблюдений не должны превышать 1-2 мм).
Аналогично проводим измерения D h для раствора ПАВ 5-6 различных концентраций. Поверхностное натяжение раствора рассчитываем по уравнению (13). Поверхностное натяжение воды в зависимости от температуры рассчитываем по уравнению (7). Экспериментальные и расчетные данные заносим в таблицу 1.
По данным таблицы 1 строим график изотермы поверхностного натяжения s = f(с) . На изотерме поверхностного натяжения выбираем 6-7 точек, к которым проводим касательные и линии, параллельные оси абсцисс . Определяем величину z и по уравнению (14) рассчитываем величину адсорбции Г . Результаты расчета заносим в таблицу 2.
По данным таблицы 2 строим изотерму адсорбция Г= f(с) и график зависимости с/Г= f(с) .
По уравнениям (17) и (18) рассчитываем значения постоянных уравнения Ленгмюра Г ¥ и k .
На изотерме адсорбции выбираем 5 точек и определяем величину В в уравнении Шишковского (21). Рассчитываем Г ¥ по уравнению (20) и сравниваем это значение с величиной Г ¥ , рассчитанное по уравнению Ленгмюра. По уравнению (19) рассчитываем постоянную А в уравнении Шишковского и убеждаемся, что А= k в уравнении Ленгмюра.
По уравнениям (22) и (23) рассчитываем высоту адсорбционного слоя d и площадь, занимаемую одной молекулой ПАВ. Делаем выводы о строении поверхностного слоя.
Ход работы:
1. Рассчитаем концентрацию ПАВ в моль/л по формуле:
См = ω*1000 / V*М, где ω концентрация ПАВ в %,V объем раствора, М молярная масса ПАВ (в нашем случае ИПС – изопропанол 60 г/моль).