Реферат: Активация малых молекул
Карбонильные комплексы известны для большинства переходных металлов. Первые комплексы были получены в конце 19-го века. Например [Pd(CO)X]n, [Pt(CO)X]n, Co2(CO)8, Ni(CO)4. Координация оксида углерода в комплексах бывает концевая (терминальная) и мостиковая (с участием двух атомов металла или трех атомов металла).

Первый тип координации является концевым и реализован во многих моно- и полиядерных комплексах, например в тетраэдрическом моноядерном тетракарбониле никеля или биядерном дикобальтоктакарбониле.
Следующие типы координации - симметричная и несимметричная мостиковая (µ- и µ3-тип) - широко распространены в химии кластеров.
Так, в кластере состава

Pd4(CO)4(OAc)4 имеются только µ-СО-группы. В кластере [Pt3(CO)6]2-n наблюдаются два типа координации СО – и концевые, и мостиковые лиганды СО, причем в каждом металлотреугольнике Pt3 представлены по три лиганда обоих типов координации.
Примеры мостиковой координации СО-группы по µ- и µ3-типу реализуются в анионном гетероядерном комплексе состава Na2{Pd4[CpMo(CO)3]4}. Здесь на каждом металлотреугольнике Pd2Mo одна СО-группа координирована по µ3-типу, а две другие – по µ-типу по ребрам Pd-Mo, причем последние СО-группы слегка асимметричные (связь Mo-C короче связи Pd-C).
|
Pd4[CpMo(CO)3]42- |
Следует добавить, что при терминальной координации карбонил является донором 2 электронов. Эта же донорная способность сохраняется в том случае, если СО координирован мостиком, но при этом направление связи С-О остается перпендикулярным ребру (или грани), на которой он координирован. В противном случае в связь с металлом начинают включаться электроны кратной связи и атома кислорода.
Как уже отмечалось выше, координация СО по обоим атомам возможна, хотя и встречается относительно редко. При такой координации происходит значительное удлинение связи С-О (от 1.13 до 1.30 А). Примеры такой координации приведены ниже.
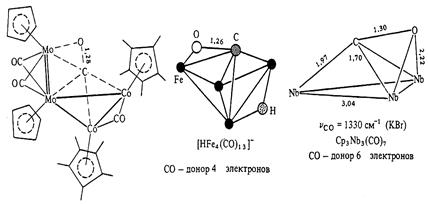
Если в образовании связи металл-лиганд участвуют оба атома, то СО-группа является донором 4 электронов. В случае, когда молекула СО расположена параллельно плоскости М3-цикла, она становится донором 6 электронов.
И, наконец, линейная координация СО отмечена в металлоорганических соединениях металлов начала больших периодов периодической системы:
(CO)5V-C-O-V-O-C-V(CO)5 или (η5-С5Me5)(Me)Ti-O-C-Mo(CO)3Cp
![]()
![]() Координационная связь между СО и переходным металлом складывается из двух компонент – донорноакцепторной ( СО – донор, металл – акцептор за счет вакантных орбиталей, например, dz2 и dx2-y2 для октаэдрических комплексов) и дативной ( металл – донор за счет заполненных dxy, dxz, dyz, СО – акцептор за счет вакантных орбиталей. Обе компоненты способствуют ослаблению связи С – О. В зависимости от степени заселения разрыхляющих орбиталей СО происходит большее или меньшее увеличение длины, понижение частоты валентных колебаний и уменьшение энергии связи С – О ( табл.)
Координационная связь между СО и переходным металлом складывается из двух компонент – донорноакцепторной ( СО – донор, металл – акцептор за счет вакантных орбиталей, например, dz2 и dx2-y2 для октаэдрических комплексов) и дативной ( металл – донор за счет заполненных dxy, dxz, dyz, СО – акцептор за счет вакантных орбиталей. Обе компоненты способствуют ослаблению связи С – О. В зависимости от степени заселения разрыхляющих орбиталей СО происходит большее или меньшее увеличение длины, понижение частоты валентных колебаний и уменьшение энергии связи С – О ( табл.)
| Молекула или ион | Энергия связи С-О, кКал/моль | Частота валентных колебаний, см-1 | Длина связи С-О, Å |
| СО (некоорд. молекула) | 256 | 2143 | 1,128 |
| СО+ | 2214 | 1,115 | |
| СО (коорд. концев.) | 2214 ¸1980 | ||
| СО (мостиков. ) | 1970 ¸ 1650 | ||
| Ni(CO)4 | 2057 | 1,15 | |
| H2CO | 170 | 1750 | 1,21 |
Из приведенных данных видно, что при координации происходит изменение свойств молекулы СО (см. выше) и координированная молекула по характеристикам приближается к карбонильной группе органических соединений. А в этом и заключается цель большинства хических процессов органического синтеза с участием СО. Изменение характеристик координированного СО приводит к изменению реакционной способности.
Наиболее характерная реакция координированного СО – реакция с нуклеофилами с образованием ацильного металлоорганического соединения:
Образование интермедиатов такого типа предполагается в процессах карбонилирования алкинов, окислительного карбонилирования спиртов, алкенов и алкинов.
Изложенная схема активации применима к большинству субстратов: алкенам, диенам, алкинам, ароматическим соединениям, СО2.
Превращения олефинов и ацетиленов относятся к важнейшим реакциям основного органического синтеза. Как правило, эти превращения включают активацию π-лигандов в π-комплексах переходных металлов. Фактически, в рамках тех понятий и терминов, которые мы обсуждаем, π-комплексы являются первичными комплексами.
π-Комплексы моноолефинов, сопряженных и несопряженных диолефинов и ацетиленов известны почти для всех переходных металлов. При этом встречаются моно-, би- и полиядерные соединения. Известны также соединения, содержащие 2, 3 и даже 4 молекулы олефина на атом металла, например, AcacRh(C2 H4 )2 , Ni(C2 H4 )3 и Ir(C2 H4 )4 Cl.
В ацетиленовых π-комплексах состава Mm (C2 R2 )n соотношение m/n меняется весьма широко. Например, известны комплексы состава Co4 (CO)10 (C2 H2 ), Pt(C2 R2 )2 , W(CO) (C2 R2 )3 .
Координация всех π-лигандов сопровождается более или менее значительными изменениями их физических характеристик – понижается частота валентных колебаний кратных связей, увеличивается длина связей С-С, изменяются величины валентных углов.
Природа химической связи в π-комплексах переходных металлов имеет много общего. Рассмотрим основные положения на примере π-комплексов олефинов и ацетиленов.
Молекула этилена по величине потенциала ионизации не отличается от молекулы аммиака (IC 2 H 4 = 10.5 эв). Донорные свойства ацетилена выражены несколько слабее (IC 2 H 2 = 11.4 эв). В ацетилене, однако, нижние вакантные МО лежат ниже, чем у этилена, поэтому молекула ацетилена характеризуется более выраженными акцепторными свойствами.
