Реферат: Биофизика мышечного сокращения
Выполнила: студентка группы ОМ 129
Берентаева К.
Факультет: Общая медицина
Проверил:Ахметов Б.Г.
Оценка:
Астана 2009
Введение
Физика и биология, на первый взгляд, довольно далекие друг от друга науки.
Но это только на первый взгляд. В действительности же в этих науках есть много общих точек. Например, в анатомии, зрение. Здесь присутствует элемент оптики: лучи света преломляются в хрусталике глаза, и элемент механики: хрусталик деформируется мышцами. Хотя, говоря о мышцах, нельзя не упомянуть о том, что их работа напрямую связана с физикой. Ведь по сути дела, механизм их действия, сокращение в связи с сокращением белковых нитей, физический процесс. А обмен веществ? Ведь питательные вещества переходят из крови в межклеточное вещество, из межклеточного вещества в клетку и из клетки в межклеточное вещество в основном из-за перепада в давлении. А нагревание внешних тканей тела кровью вследствие теплопередачи?
И физика стыкуется с биологией не только в анатомии. У птиц есть аэродинамическое оперение, у рыб гидродинамическая чешуя и боковая линия, для улавливания колебаний воды. Опять же слух…
Интерес биофизики к процессам происходящим в сокращающихся мышцах основан не только на выяснении механизмов мышечных болезней, но и что может быть даже более важным – это раскрытие механизма превращения электрической энергии в механическую, минуя сложные механизмы тяг и передач.
Для того, чтобы понять механизм и биофизические процессы происходящие в сокращающихся мышцах, необходимо заглянуть в строение мышечного волокна.
Структурной единицей мышечного волокна являются Миофибриллы – особым образом организованные пучки белков, располагающиеся вдоль клетки.
Миофибриллы в свою очередь построены из белковых нитей (филаментов) двух типов – толстых и тонких. Основным белком толстых нитей является миозин, а тонких – актин. Миозиновые и актиновые нити – главный компонент всех сократительных систем в организме. Электронно-микроскопическое изучение показало строго упорядоченное расположение миозиновых и актиновых нитей в миофибрилле. Функциональной единицей миофибриллы является саркомер – участок миофибриллы между двумя Z-пластинками. Саркомер включает в себя пучок миозиновых нитей, серединой сцепленных по так называемой М-пластине, и проходящих между ними волокон актиновых нитей, которые в свою очередь прикреплены к Z-пластинам.
1. Молекулярный механизм сокращения
Один грамм ткани скелетной мышцы содержит примерно 100 мг «сократительных белков» – актина и миозина . Механизм их взаимодействия во время элементарного акта мышечного сокращения объясняет теория скользящих нитей, разработанная Хаксли и Хансон.
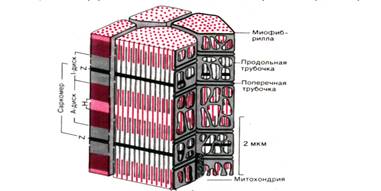
Рис. 1 . Схема участка волокна скелетной мышцы человека (по Garamvolgyi)
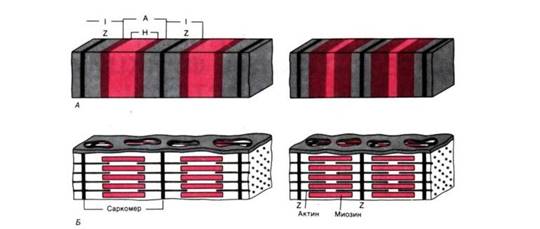
Рис. 2 . А. Поперечнополосатая структура миофибрилл: слева расслабление, справа сокращение. Б. Организация миозиновых и актиновых нитей в расслабленном и сократившемся саркомере. Аддитивный характер укорочения последовательно соединенных саркомеров.
Теория скользящих нитей
Сократительные белки актин и миозин образуют в миофибриллах тонкие и толстые миофиламенты. Они располагаются параллельно друг другу внутри мышечной клетки. Миофибриллы представляют собой сократимые пучки «нитей» (филаментов) диаметром около 1 мкм. Перегородки, называемые Z–пластинками, разделяют их на несколько компартментов–саркомеров длиной примерно по 2,5 мкм.
Согласно теории Хаксли и Хансон поперечная полосатость миофибрилл обусловлена особым взаиморасположением актиновых и миозиновых филаментов. Середину каждого саркомера занимают несколько тысяч «толстых» нитей миозина диаметром примерно по 10 нм. На обоих концах саркомера находятся около 2000 «тонких» (толщиной по 5 нм) нитей актина, прикрепленных к Z–пластинкам наподобие щетинок в щетке. Пучок лежащих в определенном порядке миозиновых нитей длиной 1,6 мкм в середине саркомера выглядит в световом микроскопе темной полосой шириной 1,6 мкм; из–за свойства двойного лучепреломления в поляризованном свете (т. е. анизотропии) она называется А–диском. По обе стороны от А–диска находятся изотропные участки, содержащие только тонкие нити и поэтому выглядящие светлыми; эти так называемые I –диски тянутся до Z–пластинок. Именно в результате такого периодического чередования светлых и темных полос в саркомерах миофибриллы сердечной и скелетной мускулатуры выглядят поперечно–полосатыми.
В покоящейся мышце концы толстых и тонких филаментов обычно лишь слабо перекрываются на границе между А– и I–дисками. Эта зона перекрывания в А–диске выглядит в световом микроскопе гораздо темнее центральной Н–зоны, в которой нет актиновых нитей. На электронных микрофотографиях Н–зоны видна очень тонкая темная М–линия в середине саркомера – сеть опорных белков, по–видимому, удерживающих толстые нити в составе единого пучка.
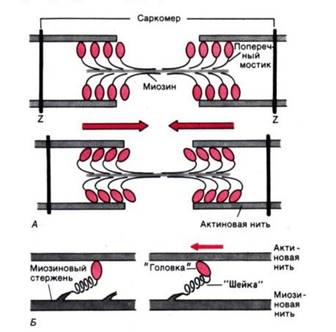
Рис. 3. Функция поперечных мостиков. А. Модель механизма сокращения: миозиновая нить с поперечными мостиками, прикрепленными к соседним актиновым нитям; вверху–до, внизу–после «гребка» мостиков (на самом деле они функционируют асинхронно) . Б. Модель механизма генерирования силы поперечными мостиками; слева– до, справа– после «гребка». Поперечные мостики химически соответствуют субфрагменту миозина–«тяжелому меромиозину», который состоит из субфрагментов I (головка) и II (шейка)
Укорочение саркомеров. Мышца сокращается в результате укорочения множества последовательно соединенных саркомеров в миофибриллах. Сравнивая структуры саркомера в двух различных функциональных состояниях, можно видеть изменения поперечной исчерченности и взаиморасположения нитей во время сокращения: тонкие актиновые филаменты скользят вдоль толстых миозиновых, двигаясь между ними к середине их пучка и саркомера.
Длина нитей не меняется и при растяжении мышцы. Тонкие филаменты попросту вытягиваются из промежутков между толстыми нитями, так что степень перекрывания их пучков уменьшается.
Работа поперечных мостиков . Миозиновые нити несут поперечные, отходящие биполярно, как показано на рис. 3, А, выступы длиной около 20 нм с головками примерно из 150 молекул миозина. Во время сокращения каждая головка (поперечный мостик) может связывать миозиновую нить с соседними актиновыми (рис. 3, А). Движение головок создает объединенное усилие, как бы «гребок», продвигающий актиновые нити к середине саркомера. Сама биполярная организация молекул миозина обеспечивает противоположную направленность (стрелки на рис. 3) скольжения актиновых нитей в левой и правой половинах саркомера.
В результате однократного движения поперечных мостиков вдоль актиновой нити саркомер укорачивается только на 2 х 10 нм, т.е. примерно на 1% своей длины. Однако при изотоническом сокращении мышцы лягушки саркомеры за десятую долю секунды укорачиваются на 0,4 мкм, т. е. на 20% длины. Для этого поперечные мостики должны совершить свои гребковые движения за указанный промежуток времени не один, а 20 раз.
Генерирование мышечной силы. Благодаря упругости поперечных мостиков саркомер может развивать силу даже без скольжения нитей относительно друг друга, т.е. в строго изометрических экспериментальных условиях. Рис.3, Б иллюстрирует такой процесс генерирования изометрической силы. Сначала головка миозиновой молекулы (поперечный мостик) прикрепляется к актиновой нити под прямым углом. Затем она наклоняется под углом примерно 45°, возможно, благодаря притяжению между соседними точками прикрепления на ней и на актиновой нити. При этом головка действует как миниатюрный рычаг, приводя внутреннюю упругую структуру поперечного мостика (видимо, «шейки» между головкой и миозиновой нитью) в напряженное состояние. Возникающее в результате упругое растяжение достигает лишь около 10 нм. Упругое натяжение, создаваемое индивидуальным поперечным мостиком, так слабо, что для развития мышечной силы, равной 1 мН, нужно объединить усилия по крайней мере миллиарда таких соединенных параллельно мостиков.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--