Реферат: Частицы и коллектив. Неразличимость и симметрия Коррекция статистических сумм для трансляции и ротации.
Принятая в термодинамике стандартизация состояний связана с давлением и скажется только на поступательной сумме состояний, поскольку лишь в ней представлен объём, и, следовательно, лишь она связана с давлением.
Её стандартное значение при некоторой температуре T получается при p=po =1 атм = 101325 Па.
Стандартный объём зависит от температуры:
Vo=RT/p o; (16)
Подставляя его в формулу (19.3) получаем выражение для стандартной поступательной суммы состояний.
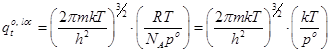 ; (17)
; (17)
Отсюда легко получается формула стандартного химического потенциала
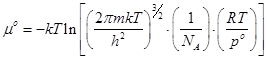 ; (18)
; (18)
Эти формулы играют основную роль в расчётах константы химических равновесий статистическим методом
6) Молекулярная сумма состояний.
Результирующая молекулярная сумма состояний образуется из молекулярных поступательной, вращательной, колебательной, электронной и ядерной сумм.
![]() ; (19)
; (19)
Поступательных степеней свободы движения у частицы всего три, и свойства этого вида движения отражены в поступательной сумме состояний. Вращательных и колебательных степеней свободы в многоатомной молекуле уже несколько. Вращения могут быть как молекулы в целом, так и связанные со взаимной подвижностью её отдельных структурных фрагментов.
Каждой степени свободы отвечает своя собственная сумма состояний.
Результирующие статистические суммы видов движений являются произведением статистических сумм по всем степеням свободы данного вида движения.
![]() ; (20)
; (20)
Мольные суммы состояний отличаются от молекулярных сумм степенью NA.
Мольные термодинамические функции получаются умножением молекулярных величин для пробной частицы на NA.
В нашем курсе мы не располагаем возможностью для применения расчётов для сложных многоатомных молекул, и потому эту тему далее не обсуждаем.
Теория предсказывает, что анализе химического равновесия в смеси идеальных газов вид молекулярных сумм состояний очень немного видоизменяется.
7) Химическая реакция в смеси идеальных газов.
Рассмотрим пробег химической реакции между несколькими частицами:
![]() (21)
(21)
Следуя правилам IUPAC, стехиометрические коэффициенты представим в виде массива
ni Î (-a, - b,… +k, +m, …); (22)
Стандартное сродство (стандартное приращение энергии Гиббса) определяется через стандартные химические потенциалы реагентов и продуктов и изотермой Вант-Гоффа связано с безразмерной термодинамической константой равновесия Kp:
![]() ; (23)
; (23)
Это и есть основание для расчёта константы химического равновесия.
Применяя правило ИЮПАК для стехиометрических коэффициентов, формулу (21.3) легко записать в общем виде