Реферат: Cложные эфиры
Винилацетат CH2 =CHOOCCH3 , образуется при взаимодействии уксусной кислоты с ацетиленом в присутствии катализатора. Это важный мономер для приготовления поливинилацетатных смол, клеев и красок.
Мыла — это соли высших карбоновых кислот.Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
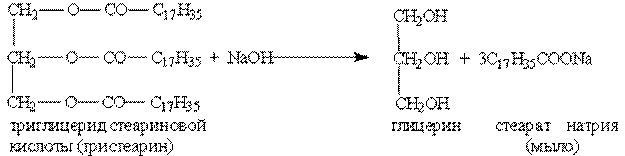
Обычное мыло плохо стирает в жесткой воде и совсем не стирает в морской воде, так как содержащиеся в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли:
Ca2+ + 2C17 H35 COONa→Ca(C17 H35 COO)2 ↓ + 2Na+
В настоящее время для стирки в быту, для промывки шерсти и тканей в промышленности используют синтетические моющие средства, которые обладают в 10 раз большей моющей способностью, чем мыла, не портят тканей, не боятся жесткой и даже морской воды.
Заключение
Исходя из вышесказанного, можно сделать вывод, что сложные эфиры находят широкое применение, как в быту, так и в промышленности. Некоторые из сложных эфиров готовятся искусственно и под названием «фруктовых эссенций» широко применяются в кондитерском деле, в производстве прохладительных напитков, в парфюмерии и во многих других отраслях. Жиры используют для многих технических целей. Однако особенно велико их значение как важнейшей составной части рациона человека и животных, наряду с углеводами и белками. Прекращение использования пищевых жиров в технике и замена их непищевыми материалами – одна из важнейших задач народного хозяйства. Эта задача может быть разрешена только при достаточно основательных знаниях о сложных эфирах и дальнейшем изучении этого класса органических соединений.
Использованные источники информации
1. Цветков Л.А. Органическая химия: Учебник для 10-11 классов общеобразовательных учебных заведений. - М.: Гуманит. изд. центр ВЛАДОС, 2001;
2. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М.,1969-70.;
3. Глинка Н. Л. Общая химия: Учебное пособие для вузов. – 23-е изд., испр./ Под ред. В. А. Рабиновича. – Л.: Химия, 1983;
4. http://penza.fio.ru
5. http://encycl.yandex.ru
Приложение
Физико-химические свойства сложных эфиров
| Название | Давление пара при 20°С, кПа | Молеку- лярная масса | Темпера- тура кипения при 101,325 кПа. °С | Плотность при 20°С. г/см3 | Показа- тель перелом- ления n20 | Поверхнос- тное натяжение 20°С. мН/м |
| Метилацетат | 23,19 | 74,078 | 56,324 | 0,9390 | 1,36193 | 24,7625,7 |
| Этилацетат | 9,86 | 88,104 | 77,114 | 0,90063 | 1,37239 | 23,75 |
| Пропилацетат | 3,41 | 102,13 | 101,548 | 0,8867 | 1,38442 | 20,53 |
| Изопропилацетат | 8,40 | 102,13 | 88,2 | 0,8718 | 1,37730 | 22,1022 |
| Бутилацетат | 2,40 | 116,156 | 126,114 | 0,8813 | 1,39406 | 25,2 |
| Изоиутилацетат | 1,71 | 116,156 | 118 | 0,8745 | 1,39018 | 23,7 |
| Втор-Бутилацетат | - | 116,156 | 112,34 | 0,8720 | 1,38941 | 23,3322,1 |
| Гексилацетат | - | 114,21 | 169 | 0,890 | - | - |
| Амилацетат | 2,09 | 130,182 | 149,2 | 0,8753 | 1,40228 | 25,8 |
| Изоамилацетат | 0,73 | 130,182 | 142 | 0,8719 | 1,40535 | 24,6221,1 |
| Ацетат монометилового эфира этиленгликоля (метилцеллозольвацетат) | 0,49 | 118,0 | 144,5 | 1,007 | 1,4019 | - |
| Ацетат моноэтилового эфира этиленгликоля (этилцеллозольвацетат) | 0,17 | 132,16 | 156,4 | 0,9748 | 1,4030 | - |
| Этиленгликольмоноацетат | - | 104 | 181-182 | 1,108-1,109 | - | - |
| Этиленгликольдиацетат | 0,05 | 146 | 186-190 | 1,106 | - | - |
| Циклогексилацетат | 0,97 | 142 | 175 | 0,964 | 1,4385 | - |
| Этиллактат | 0,13 | 118,13 | 154,5 | 1,031 | 1,4118 | 28,917,3 |
| Бутиллактат | 0,05 | 146,0 | 185 | 0,97 | - | - |
| Пропиленкарбонат | - | 102,088 | 241,7 | 1,206 | 1,4189 | - |