Реферат: Електричні властивості молекул. Поведінка речовини в зовнішньому електричному полі
Тоді ZPb * = 82 – 0,35 · 4 – 0,85 · 18 – 1 · 60 = 5,3.
Електровід’ємність. Полінг електровід’ємність визначив як здатність атома в молекулі притягувати електрони. Він (1952 р.) відмітив, що для будь-якої пари атомів АВ енергія простого зв’язку А–В, як правило більша, як середня енергія із енергій простих зв’язків А–А і В–В, тобто реакція
А2 + В2 ® 2АВ
завжди екзотермічна.
Це можна пояснити так: зв’язуючу молекулярну орбітель у молекулі АВ можно записати:
ψ = ψА + сψВ ,
де ψA і ψB – атомні орбіталі; ψ – молекулярні орбіталі.
а) Якщо коефіцієнт c > 1, то молекулярна орбіталь більше сконцентрована у атома В, який із за цього набуває від’ємний заряд, а атом А, біля якого електронна енергія зменшилась, стає додатньо зарядженим. Таким чином, зв’язок АВ стає полярним: А+ –В– .
б) Якщо c < 1, тоді А– –В+ , тобто в молекулі виникає постійний дипольний момент μD = q · d¢ (q – величина заряду; d¢ – віддаль між зарядами.
Цей іонний характер зв’язку А–В збільшить його енергію порівняно з тим, що очікувалась у випадку чисто ковалентного зв’язку. Іонна складова ковалентного зв’язку позначається Δ (дельта):
Δ = Е(А–В) – ![]() [E(A–A) + E(B–B)],
[E(A–A) + E(B–B)],
де Е(А–В), Е(А–А), Е(В–В) – експериментально визначені енергії вказаних зв’язків.
Якщо кожному атому приписати коефіцієнт електровід’ємності х як міру його електровід’ємності, тоді різниця |xA – xB | повинна бути зв’язана з с і відповідно з Δ. Полінг запропонував співвідношення: |xA – xB | = 0,208![]() ев. Далі він прийняв хn = 2,1, що дало можливість визначити електровід’ємності інших елементів, якщо відомі енергії відповідних хімічних зв’язків. Маяликен (1934) запропонував іншу інтерпретацію електровід’ємності атома, в якій розглядається перехід електронів між атомами даної пари атомів АВ. Якщо електрон переходить від А до В з утворенням тонкої пари А+ В– , це відповідає зміні енергії: ІА – ЕВ . Аналогічно, якщо електрон повністю переходить від В до А з утворенням А– В+ , зміна енергії рівня ІВ – ЕА . Якщо електрону легше перейти від А до В, то енергія цього переходу повинна виражатись рівнянням:
ев. Далі він прийняв хn = 2,1, що дало можливість визначити електровід’ємності інших елементів, якщо відомі енергії відповідних хімічних зв’язків. Маяликен (1934) запропонував іншу інтерпретацію електровід’ємності атома, в якій розглядається перехід електронів між атомами даної пари атомів АВ. Якщо електрон переходить від А до В з утворенням тонкої пари А+ В– , це відповідає зміні енергії: ІА – ЕВ . Аналогічно, якщо електрон повністю переходить від В до А з утворенням А– В+ , зміна енергії рівня ІВ – ЕА . Якщо електрону легше перейти від А до В, то енергія цього переходу повинна виражатись рівнянням:
ІА – ЕВ < ІВ – ЕА ,
ІА + ЕВ < ІВ + ЕА .
Маяликен вважав, що сума І + Е є мірою електровід’ємності атома. При відповідному коефіцієнті пропорційності коефіцієнти електровід’ємності в інтерпретації Маяликена добре погоджуються з величинами шкали Полінга.
Олрід і Рохав (1958) розглядають електровід’ємність атома як силу притягання між цим атомом і електроном, що знаходиться від ядра на віддалі ковалентного радіуса:
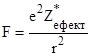 ,
,
е – заряд електрона (4,80274 · 10–10 ел-ст. д.);
![]() – ефективний заряд ядра;
– ефективний заряд ядра;
r – ковалентний радіус;
F – електростатична сила притягання.
F можна зв’язати з шкалою Полінга за допомогою рівняння:
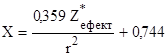 ,
,
r вимірюється в ангстремах (Å).
Приклад. Визначити коефіцієнт електровід’ємності Рb.
ZPb = 82: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p2 ;
rковPb = 1,538Å;
Zеф = 82 – (0,35 ´ число ![]() з n = 6) – (0,85 ´ число
з n = 6) – (0,85 ´ число ![]() з n = 5) – (число
з n = 5) – (число ![]() з n < 4);
з n < 4);