Реферат: Електричні властивості молекул. Поведінка речовини в зовнішньому електричному полі
![]() .
.
Мартинов і Богданов запропонували визначати електровід’ємність елементу за формулою: ![]() , де
, де ![]() – середній потенціал іонізації атома, рівний середньому арифметичному з суми потенціалів іонізації всіх зовнішніх (валентних) електронів.
– середній потенціал іонізації атома, рівний середньому арифметичному з суми потенціалів іонізації всіх зовнішніх (валентних) електронів.
Чим більша електронегативність атомів, що утворили молекулу, тим більший її дипольний момент. Розрахований дипольний момент (q · l) і визначений експериментально для одної молекули не співпадають. Наприклад:
μексп (D) μрозр (D)
СО 0,11 5,42
HCl 1,04 6,14
HBr 0,79 6,81
KCl 6,8 15,08.
Це вказує на те, що навіть у сильно іонних молекулах типу KCl немає повного переносу електрона від одного атома до іншого, а проходить тільки деформація електронної оболонки в напрямку більш електронегативного елементу.
Адитивна схема визначення дипольного моменту багатоатомної молекули. В основі схеми визначення дипольного моменту багатоатомної молекули лежить уявлення про те, що основним структурним елементом молекули є валентний зв’язок. Багатоатомну молекулу можна представити як систему хімічних зв’язків, кожен з яких можна розглядати як двохатомну молекулу з своїм дипольним моментом. Тому дипольний момент багатоатомної молекули може бути одержаний як векторна сума дипольних моментів хімічних зв’язків, що входять у молекулу. Ця схема називається адитивною. При векторному сумуванні дипольних моментів хімічних зв’язків обов’язково враховується геометрія молекули і напрямок дипольних моментів кожного зв’язку. Наприклад:
![]() = μ1 2 + μ2 2 + 2μ1 · μ2 · cos Q,
= μ1 2 + μ2 2 + 2μ1 · μ2 · cos Q,
μ1 , μ2 – дипольні моменти хімічних зв’язків;
Q – кут між цими хімічними зв’язками.
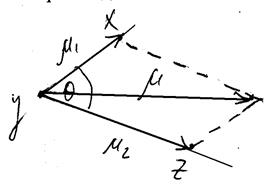
Якщо μ1 = μ2 = μ, то ![]() = μ1 2 + 2μ2 cos Q = 2μ2 (1 + cos Q).
= μ1 2 + 2μ2 cos Q = 2μ2 (1 + cos Q).
Якщо молекула має більше, ніж два зв’язки, то проводиться послідовне векторне сумування: до суми двох векторів додають третій, до результату – четвертий і т.д., враховуючи геометричне розташування і напрямок дипольних моментів хімічних зв’язків.
Як і для двохатомної молекули, розрахований і експериментально знайдений дипольний момент багатоатомної молекули не співпадають, що може бути пояснено внутрішньомолекулярними взаємодіями атомів.
Індукційний і мезомерний ефект. Індукційний ефект – зміщення електронної густини в напрямку більш електровід’ємного атома або групи атомів. Зрозуміло, що зміщення електронної густини проявляється на величині дипольного моменту. Мезомерний ефект – взаємодія π-зв’язків між собою і π-зв’язків з неподіленими р-електронними парами в атомах замісників. π–π-спряження – делокалізація π-зв’язків у бензолі і дієнових вуглеводнях з спряженими зв’язками.
Якщо в молекулі є два ефекти, то важливо знати їх напрямки паралельний чи антипаралельний. При переході від нітрометану до нітро-бензолу дипольний момент зростає (індукційний і спряжені ефекти однаково напрямлені). При переході від хлорметана до хлор-бензолу дипольний момент хлорбензола менший, ніж у хлорметана. Неподілені електронні пари Сl вступають у спряження з π-зв’язками, і електронна густина зменшується в напрямку бензольного кільця.
Дипольний момент молекул залежить від геометричної ізомерії: цис- і транс-ізомерія.
Молекули в транс-формі завжди мають центр симетрії, тому їх дипольний момент дорівнює 0.
Існування поворотних ізомерів молекул також впливає на їх дипольний момент. Наприклад, у молекулі дихлоретану СН2 Сl–CH2 Cl. Якщо вважати, що зв’язок С–Н не вносить значного вкладу в дипольний момент молекули, то її дипольний момент можна визначити як суму дипольних моментів зв’язків С–Сl. Зв’язок дипольного моменту молекули залежить від кута повороту груп СН2 Сl одна відносно іншої
![]() ,
, ![]() ,
,
φ – кут повороту.
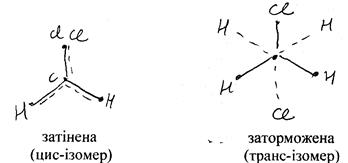
μцис = 3,4D; μтранс = 0.
На величину дипольного моменту дихлоретану впливає температура. Із зростанням температури кількість цис-ізомерів зростає, так як кількість молекул, які можуть перейти через потенціальний бар’єр, зростає.
Зрозуміло, що у випадку дихлоретану завжди є суміш цис- і транс-ізомерів. Тоді