Реферат: Этапы получение лизина
Выполнила:
студентка групи О- 55 а
Скуратовская Л. М.
Проверил:
Краснопольский Ю.М.
Харків 2010
ОСНОВНЫЕ ЭТАПЫ ПОЛУЧЕНИЯ ЛИЗИНА МИКРОБИОЛОГИЧЕСКИМ ПУТЕМ
В отличие от производства кормовых дрожжей промышленное получение лизина и других аминокислот осуществляется в строго асептических условиях, на стерильных питательных средах с использованием чистой культуры продуцента. Принципиальная технологическая последовательность процесса получения лизина следующая: приготовление посевного материала; подготовка и стерилизация питательной среды, всей аппаратуры и коммуникаций; культивирование продуцента в промышленных ферментаторах (ферментация); выделение целевого продукта (L-лизина).
Приготовление посевного материала
Посевная культура продуцента может быть приготовлена двумя способами; периодическим и непрерывным. В настоящее время на биохимических заводах, выпускающих лизин, приготовление посевной культуры ведется преимущественно периодическим методом.
Свободную от фага и посторонней микрофлоры исходную культуру продуцента с чашек Петри с агаром Хоттингера пересевают в пробирки с 2%-ным мясопептонным агаром и выращивают в течение суток при температуре 29-30 °С. На основе этой культуры готовят на стерильной водопроводной воде суспензию плотностью 108 клеток на 1 мл (ориентировочно 8-10 мл воды на одну пробирку). Полученной суспензией засевают стерильную питательную среду в качалочных колбах.
Для получения посевного материала используют среды различного состава. Чаще всего в среду входят меласса (3-5 %), кукурузный экстракт (2,5-3,0 %) и поваренная соль (до 0,4 %). Среду подтитровывают 20 %-ным раствором едкого натра до величины рН 7-7,2. В качалочные колбы объемом 750 мл заливают по 100-120 мл среды и стерилизуют в автоклаве. После охлаждения среду в каждой колбе засевают 2 мл посевной суспензии и выращивают куль-туру в течение суток на качалках (180-200 об/мин) при температуре 29-30 °С - это так называемые маточные посевные колбы. Затем засевают посевные колбы со средой того же состава из расчета 5 % маточной суточной культуры. Посевные колбы выдерживают на качалках в течение суток при температуре 30 °С. Культурой из посевных колб засевают первый инокуля-тор из расчета 0,05- 0,1 % по объему и выращивают ее в течение суток отъемно-доливным способом при аэрации и перемешивании. Температура выращивания 29-30 °С.
В инокуляторе состав среды может быть таким же или другим, более близким к производственной питательной среде. Для каждого продуцента состав среды устанавливают экспериментально.
Посевную срелу стерилизуют, как правило, в посевном аппарате. Если производственные ферментаторы имеют очень большую емкость или производительность завода велика, предусматривают еще одну ступень инокуляторов, объемы которых больше предыдущих, так как количество задаваемой в аппарат посевной культуры сравнительно высоко (1-5, а для ряда продуцентов 20-30 % по объему). Следует помнить, что при периодическом способе получения посевной культуры независимо от количества стадий длительность выращивания продуцента на каждой стадии составляет 16-24 ч.
В настоящее время предложен и разработан для производства L-лизина непрерывный способ получения посевного материала. Обновление исходной культуры и первые этапы размножения культуры осуществляют в лабораторных условиях, но вместо качалочных колб выращивания культуры проводят на специальном лабораторном стенде в небольших аппаратах с автоматическим регулированием заданных параметров, что позволяет значительно увеличить количество получаемой культуры и сократить время выращивания производственной культуры за счет увеличения дозы посевного материала.
В инокулятор загружают стерильную среду на 1/3 объема, задают с лабораторного стенда 5-6 % посевной культуры, подключают инокуляторы к сборнику со стерильной питательной средой и при интенсивной аэрации и перемешивании среды осуществляют выращивание до тех пор, пока среда с культурой не займет 1/2 полного объема инокулятора. Затем начинают подачу культуральной жидкости из ниокулятора в посевной ферментатор, в который поступает и свежая питательная среда. Скорость подачи среды и культуры зависит от физиологических особенностей продуцента. Когда посевной ферментатор будет заполнен на 0,6 (полное заполнение), подачу культуры из инокулятора переключают на следующий посевной ферментатор и т. д. Из посевного ферментатора готовый посевной материал направляют в производство или в предварительно простерилиэованные сборники объемом 25-35 м3 .
Такая схема позволяет использовать в производстве до 30 % посевного материала. По этой схеме из инокулятора поток культуры направляют в посевной аппарат только во время загрузки. Инокулятор или посевной аппарат поочередно выполняют функции промежуточной емкости для обеспечения непрерывности при поочередной подготовке и стерилизации аппаратуры. Когда схема работает на установившемся режиме, три посевных ферментатора находятся в стадии выращивания культуры, а четвертый - в состоянии подготовки. Межстерилиэационный период для аппаратуры, предназначенной для производства посевной культуры - продуцента аминокислот, составляет 72 ч. Таких линий на производстве может быть несколько в зависимости от производительности предприятия и количества задаваемого посевного материала. При использовании посевного материала, полученного методом непрерывного культивирования, и содержании его в среде в количестве более 15 %, время ферментации сокращают на 17-25 %.
Экономический коэффициент образования лизина не зависит от методики приготовления посевного материала. Но используя непрерывный способ, следует помнить, что при длительной работе батареи возможно возникновение ревертантов и утрата свойств продуцентом. Наблюдение за культурой здесь особенно важно.
Инокуляторы или посевные ферментаторы имеют сравнительно простые конструкции. Главное требование - это минимальное количество штуцеров, смотровых окон, люков, отсутствие вращающихся деталей, надежные устройства для герметизации ферментатора. Перспективны посевные ферментаторы с пневматическим перемешиванием, где диспергирование достигается при введении в ферментатор воздуха через сопло с коническим расширением. Диаметр отверстий сопла от 1 мм в лабораторных до 10 мм в промышленных инокуляторах. Конструкция посевного ферментатора приведена на рис. 1.
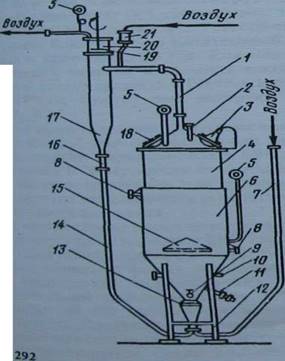
Рис. 1. Сопло-конусный ферментатор ФСКА-3 с системой циркуляции и пенога-шеиия:
1 — ввод пены с воздухом в циклон; 2 — посевной штуцер; 3 — светильник; 4 — корпус ферментатора; 5 —манометры; 6 — пароводяная рубашка; 7 — подвод воздуха; 8 — штуцера для воды, пара и конденсата; 9 — пробоотборник; 10 и 11 — штуцера для термометра и отвода культуральной жидкости; 12 — опора аппарата; 13 — аэратор; 14 - обратная труба; 15 - конический барботер; 16 и 19 — смотровые окна; 17 — циклон; 19 — лопасти пеногасителя; 20 — стеклянная часть циклона; 21 — подача питательной среды.
При использовании этого аппарата можно обойтись без химического пеногасителя.
Готовая посевная культура независимо от способа ее выращивания должна быть свободна от фага (для продуцентов из рода Вгеvibacterium), посторонней микрофлоры и иметь титр около 109 клеток на 1 мл.
Приготовление и стерилизация питательной среды, аппаратов и коммуникаций
Промышленная технология лизина, разработанная в нашей стране, предусматривает использование питательной среды для выращивания продуцентов лизина, состоящей из мелассы, кукурузного экстракта или другого источника ростовых веществ, мела и пеногасителя. Однако в связи с дефицитностью мелассы и кукурузного экстракта в настоящее время проводится поиск новых дешевых компонентов для их частичной или полной замены, обеспечивающих сбалансированность питательной среды для действующих лизиновых заводов.
В качестве заменителей кукурузного экстракта используют ферментативный гидролизат БВК, при этом ферментолизат БВК, внесенный в питательную среду вместо кукурузного экстракта, должен обеспечить концентрацию аминного азота 0,06 %. В этих условиях уровень биосинтеза лизина культурой Вгеvibacterium 22ЛД (промышленный штамм) на 60 % выше, чем с кукурузным экстрактом (при содержании мелассы по РВ 10 %).
Установлено также, что замена кукурузного экстракта в питательной среде нативной молочной сывороткой (рН 4, РВ 2,5 %, СВ б, NH2 0,05 %) в количестве 0,04 % по аминному азоту обеспечивает выход на 10 % больше, чем регламентная среда. Использование выпаренной молочной сыворотки (рН 3,9, РВ 10,8 %, СВ 25, NH2 0,23 %) в количестве 0,05 % по аминному азоту вместо кукурузного экстракта способствует повышению накопления лизина на 67 %, при этом сокращается расход мелассы за счет молочного сахара, содержащегося в сыворотке.
В качестве стимулятора роста культур - продуцентов лизина возможно использование водорослей Fucus vusiculosus, в которых содержатся ростовые вещества группы В по классификации Н. Вильсона и В. Гартелиуса. Выход лизина при введении в питательную среду экстракта высушенных и размолотых водорослей увеличивается на 40-50 %.
В нашей стране разработана новая комплексная технологическая схема производства ферментного препарата глюкоамилазы при глубинном культивировании гриба Asp. awamoriF-122, отходы производства которого используются в качестве питательной среды для производства L-лизина: ультрафильтрат (источник углерода, азота и неорганических солей) и мицелий Asp. awamoriF-122 (источник органического азота). Ультрафильтрат после концентрирования ферментного раствора в количестве 964 л на 1 м3 раствора, поступающего на концентрирование, ранее сливался в канализацию, а биомасса (мицелий) направлялась на отвал. Состав ультрафильтрата следующий (в %): СВ 5,5-6, РВ 4-4,5, общий азот 0,18-0,2, аминный азот 0,03-0,04. Содержание сырого протеина 11 г/л. В биомассе, которая образуется в количестве 200-250 кг на 1 м3 культуральной жидкости (при влажности 70 %), содержится до 5 % белка, 0,4-0,5 углеводов, 0,15-0,25 % аминокислот в большом ассортименте. Культивирование продуцентов лизина Согуn. glutamicum Т-3 и Brevibacteriumsp. 22L проводят на питательных средах, приготовленных на основе стерильного ультрафильтрата с рН 7-7,4, содержанием cахаров 8-12 %, аминного азота 0,08-0,1, общего азота 0,4-0,6 %. Туда же добавляют 2-3 % (по сухой массе) экстракта мицелия Asp. awamoriF-122. Выход лизина через 48-50 ч культивирования на такой среде 40-45 г/л.
Обычно питательную среду готовят и стерилизуют в две стадии с учетом свойств компонентов, входящих в ее состав. Стадия подготовки и стерилизации среды состоит из смешивания компонентов питательной среды в определенной пропорции с помощью специальных дозаторов в реакторе, растворения солей при перемешивании, нагрева до температуры стерилизации, выдержки при этой температуре и охлаждения до температуры, при которой проводится культивирование продуцента лизина.
В производстве лизина используют мелассу, содержащую термолабильный компонент - сахарозу. Поэтому ее стерилизуют отдельно. В реактор, снабженный мешалкой, подают мелассу, нагревают при постоянном перемешивании до температуры 80 °С, разбавляют водой согласно имеющейся рецептуре, затем быстро разогревают глухим паром до температуры 120-122 °С в специальном аппарате и выдерживают при этой температуре определенное время, необходимое для полной гибели микрофлоры. Остальные компоненты среды смешивают также в реакторе с мешалкой и растворяют в воде с подогревом, нагревают в специальном аппарате до температуры стерилизации, выдерживаютпри этой температуре и охлаждают. Длительность, стерилизации при этом значительно меньше, но температура выше.
Пеногаситель часто стерилизуют отдельно, особенно в том случае, когда им является масло или жир. Режимы стерилизации (температура и длительность) при обработке пеногасителя более жесткие, чем это принято для стерилизации любых питательных сред.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--