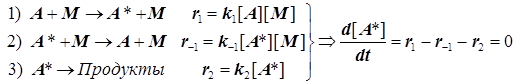 (4.9)
(4.9)
Отсюда следует простой результат.
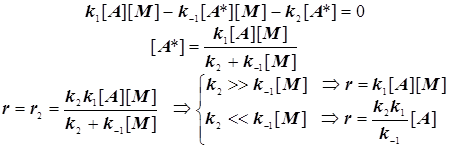 (4.10)
(4.10)
Экспериментальные данные часто не вполне соответствуют простой формально-кинетической схеме Линдемана, однако теоретические уточнения позволяют достичь приемлемого количественного и качественного согласия наблюдаемых фактов с этим механизмом. Всё же в основном идея балансирования между стадиями активации, дезактивации и самого превращения оказывается верна.
Пример 4.1 , илюстрирующий схему Линдемана: Реакция разложения диметилового эфира 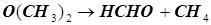
5) О роли газокинетических моделей, из которых вытекают основные воззрения химической кинетики и о доводах в её пользу. (Забегаем немного вперед в части представлений об активации химического процесса).
Пример 5.1) Реакция разложения дийодэтана C2H4J2 = C2H4+J2 описывается единым уравнением Аррениуса и в газовой фазе, и в растворе в CCl4. Этот случай наиболее прямое свидетельство в пользу единой кинетической модели реакции в газе и в жидкости. Распределение Максвелла-Больцмана оказывается в растворе ещё устойчивее, чем в газе, и теория активных соударений оказывается весьма удачной. Причина этого состоит в особенно эффективном механизме перераспределения энергии при соударениях частиц в жидкой фазе. График температурной зависимости константы скорости этой реакции качественно выглядит примерно следующим образом.
|
Следует далее обязательно рассмо треть кинетические модели элементарных процессов, показывая общность кинетических приёмов описания процессов. Это:
-кинетические модели случайных дви-жений, -внутримолекулярные движения, -эмиссия и абсорбция фотонов, -время жизни, время корреляции и константа скорости, -средние хронологические физические наблюдаемые в случайных движениях... | |
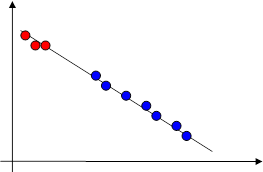
Рис. 9. Пример единой аррениусовской зависимости в газовой и жидкой фазах.
К-во Просмотров: 340
Бесплатно скачать Реферат: Формальная кинетика сложных реакций
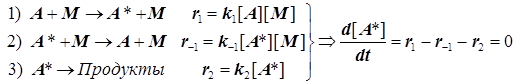 (4.9)
(4.9)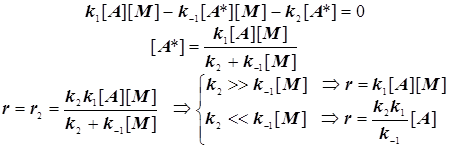 (4.10)
(4.10)![]()
