Реферат: Группа пневмовирусов
Доказательствами специфичности иммунофлуоресценции могут служить:
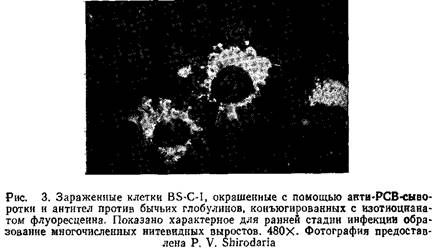
1) отсутствие флуоресценции незараженных клеток BS-C-1;
2) отсутствие флуоресценции при использовании ЭТС вместо специфической с зараженными РСВ клетками;
3) отсутствие флуоресценции после истощения противовирусной сыворотки зараженными клетками.
Высокой чувствительностью обладает и иммунопероксидазный метод; его преимущество состоит в том, что он не требует использования микроскопа с ультрафиолетовой оптикой.
2.6 Твердофазный иммуноферментный анализ
ELISA - еще один иммунологический метод быстрого обнаружения и количественного определения РСВ. Ниже приведена типичная методика.
1. Лунки планшета для иммунологических реакций покрывают зараженными или незараженными клетками, или РСВ, очищенным центрифугированием в градиенте. Это делается одним из следующих методов:
а) клетки выращивают в лунках планшета и через ряд заражают РСВ. Когда в лунках с зараженными клетками проявляется ЦПД, клетки промывают, фиксируют раствором, содержащим этанол и уксусную кислоту, и хранят при - 20 °С;
б) в лунки планшета вносят РСВ, очищенный центрифугированием в градиенте, и высушивают в течение ночи при 37°С.
Если имеются клетки, персистентно инфицированные РСВ, их можно использовать в качестве источника антигена вместо литически инфицированных клеток.
2. Перед началом анализа все лунки планшета покрывают 5% -ным раствором БСА в PBS. В каждый опыт следует включать негативный контроль и позитивный контроль. В лунки планшета вносят образцы вируса и инкубируют в течение ночи при 4°С. Планшет промывают и добавляют овечьи антитела против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена в рекомендуемом разведении. Планшет инкубируют 1 ч при 37 °С, промывают, добавляют субстрат, о-фенилендиамин, и инкубируют при 37 °С еще 30 мин. Реакцию останавливают добавлением 4,5 М H2SO4 и учитывают результаты с помощью ридера "Мультискан".
Хиерхольцер и др. описали методику, позволяющую с помощью ELISA количественно выявлять белковые полосы после электрофореза и переноса белков на нитроцеллюлозные мембраны, так называемый метод "вестерн-блотинга". Преимущество этого метода состоит в том, что он не требует использования радиоактивных изотопов.
3. Аналитические методы
3.1 Радиоактивное лечение, радиоиммуноанализ и радиоиммунопреципитация
3.1.1 Введение радиоактивной метки в вирусные белки в зараженных РСВ клетках
1. Оптимальные условия для мечения вирусных белков достигаются при добавлении к зараженным клеткам через 18 ч после заражения актиномицина D в концентрации 2,5 мкг/мл.
Белки РСВ удается эффективно пометить смесью - Meтионина и - цистеина по следующей методике.
2. Через 2 ч после внесения актиномицина D культур ал ьную среду заменяют на среду, содержащую 50 мкКи/мл L--Meтионина и 25 мкКи/мл Ь--цистеина. у
3. Клетки инкубируют 16 ч при 37 °С или до проявления выраженного ЦПД.
4. Монослой промывают, солюбилизируют клетки и экстрагируют белки лизирующим буфером.
5. После инкубации в течение 2 ч при комнатной температуре лизат используют для электрофореза или хранят при - 20 °С.
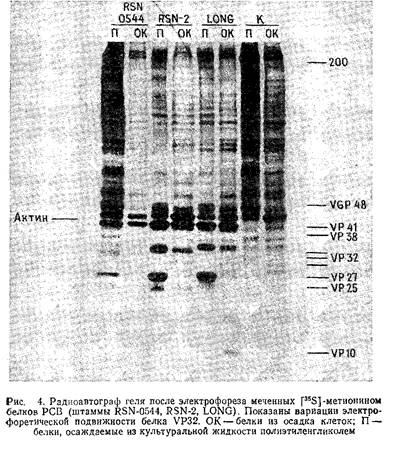
Рис.4 иллюстрирует результаты разделения меченных - метионином белков РСВ в пластине 10% -ного полиакриламидного геля. Вирусные гликопротеины можно пометить аналогичным методом, используя в качестве метки 50 мкКи/мл - глюкозамина или - маннозы. Альтернативный метод введения метки в гликопротеины оболочки РСВ заключается в йодировании поверхности зараженных вирусом клеток лактопероксидазным методом. Белки очищенного нуклеокапсида РСВ можно йодировать с помощью хлорамина Т.
3.1.2 Радиоиммуноанализ
Метод прямого RIA с использованием в качестве вторых антител меченных 125 1 гамма-глобулинов сыворотки козы против глобулинов мыши, а в качестве субстрата - фиксированных метанолом персистентно инфицированных РСВ клеток описан Коутом и др. .
3.1.3 Радиоиммунопреципитация
Радиоиммунопреципитация проводится стандартным методом, описанным, например, Ферни и Герином и Уордом и др. Для РСВ применяют следующую методику.
1. "Монослойные культуры клеток в чашках Петри диаметром 50 мм заражают РСВ с множественностью инфекции более 1 БОЕ/кл. Через определенные промежутки времени после заражения проводят импульсное мечение. Для этого культуральную среду в чашках заменяют на 1 мл PBS, содержащего 30 мкКи - метионина и 25 мкКи - цистеина, и инкубируют чашки при 31 °С 1 ч.
2. Радиоактивный раствор сливают и монослой промывают охлажденным PBS.
3. Клетки снимают со стекла с помощью стерильной резиновой палочки и осаждают центрифугированием.
4. Клетки ресуспендируют в 200 мкл лизирующего буфера, инкубируют суспензию 30 мин в ледяной бане, затем интенсивно перемешивают.
5. Ядра и клеточный дебрис удаляют центрифугированием 5 мин при 10 000 g.
6. Лизат осветляют инкубацией с 50 мкл 10% -ной суспензии фиксированных формалином стафилококков или с 50 мкл суспензии покрытых белком-А гранул 30 мин при 0°С.