Реферат: Губкообразная энцефалопатия крупного рогатого скота
оральный
В качестве примера зависимости от дозы и пути поступления инфекта служат эксперименты, которые показали, что доза, необходимая для заражения прионами мышей при оральном пути должна быть в 200 000 раз выше, чем при интрацеребральном.
При попадании инфекционного прионного белка в здоровый организм в нем начинается следующее (рис.3): в результате соединения одной молекулы инфекционного прионного белка (РrРSс) с одной молекулой клеточного (нормального) прионного белка (РrРС) в молекуле последнего происходят пространственные изменения. А именно: две из четырех спирально завитых структур в молекуле клеточного прионного белка (А) вытягиваются. Именно это пространственное изменение приводит к тому, что молекула такого белка становится инфекционной: РrРSс + РrРС = 2 РrРSс и так далее...
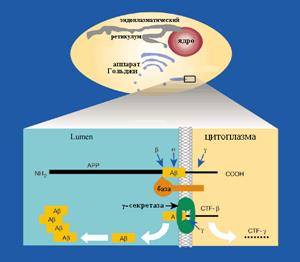
рис.3. Размножение прионов в клетках
Таким образом, в отличие от всех известных инфекционных агентов, инфекционный прионный белок не синтезируется заново, а накапливается исключительно за счет превращения нормального клеточного белка в инфекционный.
Видовой барьер.
Трансмиссия прионовых губкообразных энцефалитов у лабораторных и диких животных длительное время является предметом многочисленных исследований. Замечено, что при первом проявлении болезни у определенного вида животных время инкубации очень длительное, тогда как после первого же пассажа новому хозяину в пределах этого же вида, оно сокращается. В последующих пассажах оно уменьшается еще больше до тех пор, пока не достигнет стабильного периода, характерного для данного вида. Эта устойчивость к прионовой инфекции у различных видов получила название "видовой барьер". Установлено, что для преодоления видового барьера и распространения заражения внутри самого вида необходимы очень высокие дозы инфекта. Однако исследователи обратили внимание на тот факт, что при одинаковой дозе инфекта трансмиссивность подострых губкообразных энцефалитов в одних случаях (например, скрепи овец) зависит от источников агента, а в других — сразу и от вида донора, и от вида реципиента.
Обнаружено, что при различных способах введения патологических прионов через различные периферические пути, включая брюшную полость, желудок, инфекционный агент сначала появляется в клетках лимфоретикулярной системы миндалин, тимуса, лимфатических узлов и, особенно, селезенки. В первую очередь инфект определяется в B-клеточных зонах.
Авторы показали, что дифференцированные B-лимфоциты принимают участие в нейроинвазии прионов. Это, по их мнению, может иметь значение для предупреждения болезни и использовано в терапевтических целях.
При алиментарном заражении прионы в Пейеровых бляшках тонкой кишки проникают через клеточные мембраны во внутренние структуры лимфоидных клеток, откуда в дальнейшем они попадают в другие органы иммунной системы: лимфоузлы, селезенку, миндалины и др. В этих органах возможна частичная репликация прионов. Предполагается, что дендритные клетки являются пермиссивными для периферической репродукции прионов. Из органов иммуногенеза прионы по нервам достигают ближайших аксонов. В области аксона может происходить их значительная репликация. При достижении критической концентрации прионы продвигаются по направлению к спинному, а затем головному мозгу.
После подкожного заражения грызунов прионы выделяются из селезенки (1-я неделя после заражения), из селезенки и лимфатических узлов (5-13-я неделя), из спинного мозга (13-17-я неделя) и из головного мозга (17-19-я неделя). Установлено, что патологические изменения в мозге появляются на 25-й неделе, а клинические проявления начинают регистрироваться с 34-й недели. Все пораженные органы содержат до 10 млн. инфекционных единиц на 1 г, однако в них, за исключением головного мозга, не обнаруживается никаких патологических изменений. По некоторым данным, максимум инфекционности достигается к 40-му дню, т.е. задолго до клинического заболевания у внешне совершенно здорового животного, когда еще нельзя распознать болезнь и принять меры по профилактике и лечению. Из этого обстоятельства вытекают трудности ранней диагностики и опасность передачи инфекции с продуктами питания.
Экспериментально доказано, что репликация прионового агента может происходить как в нейронах, так и в глиальных элементах. Некоторые авторы считают, что астроциты и другие глиальные клетки, возможно, играют ключевую роль в патогенезе прионовой инфекции. Это подтверждается высоким уровнем цитокинов на поздней стадии заболевания. К тому же на линейных мышах, у которых инфицированы были только глиальные клетки, получена морфологическая картина губкообразной энцефалопатии.
Инфицированность органов иммуногенеза подразумевает перенос инфекционного агента с кровью. Однако ни в инкубационном периоде, ни в преклинической стадии, ни даже в разгар болезни пока не находят биологических сдвигов в периферической крови.
После внутрицеребрального внедрения в животный организм прион-протеина PrP-Sc, он начинает избирательно накапливаться в мозге. Имеются доказательства существования транспорта PrPC и PrPSc вдоль аксонов. Большинство клеточных прионов протеина присоединяются к внешней поверхности мембраны клеток якорем гликопротеидов после прохождения через комплекс Гольджи. Подобно другим протеинам, изоформа прион протеина PrPSc проходит внутрь клетки через фиссуры, находящиеся на поверхности клетки. В отличие от клеточной изоформы прион-протеина PrPSc накапливается в клетке.
Иммуно-электронномикроскопические исследования указывают на то, что накопление PrPSc происходит в структурах вторичных лизосом, содержащих фигуры миелина, богатые фосфолипидами. После повреждения лизосом и гибели клетки прионы заселяют другие клетки. Внутриклеточное накопление PrPSc в головном мозге проявляется губкообразной дистрофией нейронов, гибелью нервной клетки и реактивным астроцитозным глиозом, что и определяет нейроморфологию прионовых заболеваний.
Патоморфология прионовых энцефалопатий.
Нейропатология прионовых болезней человека характеризуется 4 классическими микроскопическими признаками:
губкообразными изменениями
потерей нейронов
астроцитозом
формированием амилоидных бляшек
Макроскопически во всех случаях прионовых энцефалопатий отмечено незначительное уменьшение массы головного мозга, в отдельных наблюдениях отмечена умеренная атрофия извилин, главным образом у лиц с пролонгированным течением заболевания.
Микроскопически прионовая губкообразная энцефалопатия характеризуется наличием множества овальных вакуолей (спонгиоз) от 1 до 50 микрон в диаметре в нейропиле серого вещества конечного мозга. Вакуоли могут выявляться в любом слое коры мозга. Это могут быть отдельные вакуоли или группы, разделенные на участки. На парафиновых срезах вакуоли выглядят оптически пустыми, однако в некоторых из них при окраске гематоксилином и эозином нередко выявляется мелкая зернистость. Вакуоли могут сливаться в микроцисты (200 микрон и более), в результате чего существенно искажается цитоархитектоника коры. В цитоплазме больших нейронов коры также может выявляться вакуолизация.
Помимо коры губкообразные изменения нейропиля и вакуолизация цитоплазмы нейронов отмечаются по ходу всех полей аммоновых рогов, по ходу зубчатой фасции, в области подкорковых ядер, таламусе и коре мозжечка. Вовлечение в патологический процесс мозжечка является наиболее характерным проявлением этой болезни, хотя степень спонгиоза в нем очень вариабельна. Слияние вакуолей не характерно для мозжечковых повреждений. Спонгиоз чаще представлен микровакуолями диаметром 1-50 микрон, расположенными в молекулярном слое.
Губкообразные изменения постоянно сопровождаются уменьшением числа нейронов различных отделов коры. В основном страдают нейроны III-VI слоя. В отдельных сохранившихся нейронах отмечается вакуолизация цитоплазмы, некоторые нейроны сморщены, гиперхромны. Степень выпадения нейронов коррелирует с выраженностью губкообразных изменений и соответствует длительности заболевания. Описанные признаки сочетаются с пролиферацией клеток астроглии. В пролиферирующих астроцитах обнаружены различные дистрофические изменения, начиная с вакуолизации цитоплазмы и кончая появлением тучных форм с последующим клазматодендрозом. Миелиновые волокна коры остаются неизменными.
При длительном течении заболевания наиболее выражены вакуолизация и выпадение нейронов, что сопровождается спонгиозным статусом, с широко распространенной во всех отделах грубой вакуолизацией, полным коллапсом коры головного мозга в виде нерегулярно искаженного каркаса глиальной ткани с небольшими вкраплениями сохранившихся нейронов. Вообще, чем дольше длится течение болезни, тем более явными будут микроскопические изменения. В базальных ганглиях и таламусе выраженная гибель нейронов может сочетаться с глиозом и атрофией. В мозжечке наблюдаются резкие дистрофические изменения вплоть до гибели зернистых клеток и клеток Пуркинье. Сохранившиеся клетки Пуркинье гиперхромные, набухшие, с явлениями тигролиза и лизисом ядер. Миелиновые волокна, прилежащие к коре и ядерным группам мозжечка, часто варикозно вздуты, с явлениями фрагментации. Вместе с тем, необходимо подчеркнуть, что демиелинизация волокон при всех формах прионовых болезней не наблюдается.
Одним из морфологических признаков прионовых энцефалопатий является наличие прион-протеиновых (PrP) бляшек, которые обычно видны как округленные эозинофильные структуры. Изучение структуры и топографии PrP бляшек имеет большое как теоретическое, так и практическое значение. Количество, локализация и даже микроскопические признаки бляшек варьируют при различных формах и типах прионовых энцефалопатий. Такие бляшки характерны для болезни Куру. Многие авторы их так и называют Куру-бляшки. Реже они встречаются при спорадической и семейной болезни Крейтцфельда-Якоба, но очень часто (более 70%) — при ее новой форме. В единичных наблюдениях их описывают при семейной фатальной бессоннице.
Очень часто PrP амилоидные бляшки локализуются в клетках зернистого слоя коры мозжечка, но могут также располагаться в молекулярном слое и в белом веществе. Они, как правило, окружены бледно-розовым ореолом. Интенсивность окрашивания бляшек различна. Возможно, поэтому их не всегда удается обнаружить. Для этого используют стандартные иммуногистохимические методы с PrP антителами. В обнаруженных полимерах протеина, после окраски конго-рот, при поляризационной микроскопии выявляется зеленое двойное лучепреломление.
Спинной мозг визуально практически сохранен. Лишь иногда отмечают значительное уменьшение числа мотонейронов. Ни в одном из наблюдений не было выявлено демиелинизации белого вещества спинного мозга. Несмотря на относительно высокую концентрацию прионов, наблюдаемую в периферических нервах, выраженных структурных изменений в них нет.
Клиника всех форм прионовой энцефалопатии может быть представлена разнообразной неврологической симптоматикой, обусловленной вакуолизацией и гибелью нейронов (основной механизм действия прионов на клеточном уровне) практически в любом отделе серого вещества мозга, включая мозжечок. Типичными являются: