Реферат: Иммобилизованные БАС как основа создания ЛФ нового поколения. Примеры носителей. Методы
Подготовила:
Прасолова Ю., 452 гр.
Проверила : Талыкова Н.М.
Барнаул, 2010
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Сущность иммобилизации ферментов — прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно, химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). При этом допускается прикрепление фермента только за счет функциональных групп, не входящих в активный центр фермента и не участвующих в образовании фермент-субстратного комплекса. Носитель фермента или матрица может иметь вид зернистого материала, волокнистой структуры, пластинчатой поверхности, пленок или тканей, полых волокон, трубочек, капсул и т. д. Имеет значение размер частиц носителя. Важно иметь большую поверхность, поэтому рекомендуются небольшие частицы диаметром 0,1—0,2 мм. Носитель фермента может быть как природное вещество, так и синтетический полимер.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Классификация носителей для ферментов
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования (Дж.Порат, 1974):
· высокая химическая и биологическая стойкость;
· высокая химическая прочность;
· достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
· возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
· легкая активация;
· высокая гидрофильность;
· невысокая стоимость.
Классификация носителей схематично представлена на рисунке 1
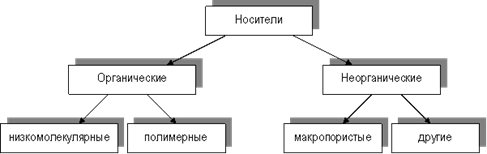
Рис1 Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные.
Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенностью этой группы носителей также является их высокая гидрофильность. Недостаток природных полимеров - неустойчивость к воздействию микроорганизмов и довольно высокая стоимость.
Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д.
Широко распространены носители на основе декстрана, выпускаемые под названием "сефадексы". При высушивании они легко сжимаются, в водном растворе сильно набухают. В этих носителях размер пор в геле регулируется степенью сшитости. К группе декстранов относят и крахмал. Химически модифицированный крахмал сшивается агентами, такими как формальдегид. Таким способом был получен губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизу. Водорастворимые препараты на основе декстрана часто применяются как носители лекарственных средств в медицине.
Хорошим носителем считается агар. Его свойства улучшаются после химической сшивки, например, диэпоксидными соединениями. Такой агар становится устойчивым к нагреванию, прочен, легко модифицируется.
Белки в качестве носителей обладают рядом достоинств: вместительны, способны к биодеградации, могут применяться в качестве тонкой (толщиной 80 мкм) мембраны. Иммобилизацию ферментов на белковых носителях можно проводить как в отсутствие, так и в присутствии сшивающих агентов. Белки используются и в фундаментальных биологических исследованиях, и в медицине. К недостаткам белков в качестве носителей относят их высокую иммуногенность (за исключением коллагена и фибрина). Наиболее для иммобилизации используются структурные (кератин, фибрин, коллаген), двигательные (миозин) и транспортные (альбумин) белки.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--