Реферат: Іонні механізми потенціалу дії. Методи фіксації
По-друге, ця конфігурація не дозволяє контролювати склад середовища поза піпеткою - там залишається цитоплазма, склад якої не цілком визначений. У силу цих причин cell-attached mode застосовується досить обмежено.
Конфігурація Іnsіde-out
Однак, якщо піпетку швидким рухом відвести від клітини, то "внутрішній" шматочок мембрани відірветься від клітини й вийде конфігурація іnsіde-out (зовнішня сторона усередині), названа так тому, що внутрішня, звичайно звернена до цитоплазми, сторона мембрани виявиться зовні - в оточуючому розчині, а зовнішня - усередині піпетки. (Схема 2) Альтернативний метод переходу в конфігурацію іnsіde-out полягає в наступному: з конфігурації cell-attached піпетку відводять плавно, формуючи із двох сторін закриту везикулу; потім піднімають піпетку в повітря й опускають у другу ванночку, із внутрішньоклітинним розчином. При переносі зовнішня мембрана везикули руйнується, у результаті формується конфігурація іnsіde-out.
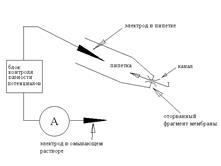
Схема 2. Принципова схема patch-clamp у конфігурації іnsіde-out.
Тепер різниця потенціалів на фрагменті мембрани строго дорівнює різниці потенціалів між електродами. Очевидно, що при використанні такої модифікації піпетку заповнюють розчином, що імітує позаклітинне середовище, тоді як оточуючий розчин роблять близьким по складу до цитоплазми. При цьому, міняючи склад оточуючого розчину, можна вивчати, як такі зміни в цитоплазмі впливають на струм каналів, що цікавлять нас, - адже оточуючий розчин контактує із цитоплазматичною стороною мембрани.
Конфігурація Whole-cell
Якщо за умовами експерименту необхідно міняти склад позаклітинного середовища, можна використати конфігурацію whole cell ("англ. ціла клітина"). У цьому випадку піпетку не відводять від клітини, а подають у неї негативний тиск й у такий спосіб руйнують ізольований фрагмент мембрани.
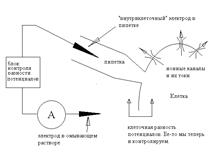
Схема 3. Принципова схема patch-clamp у конфігурації whole-cell.
Після цього піпетка з'єднана із внутрішньоклітинним середовищем; оскільки клітина звичайно маленька, то, завдяки дифузії, склад цитоплазми незабаром виявляється ідентичним складу піпеткового розчину, тому ми, як й у попередньому випадку, знаємо як склад рідин, так і різницю потенціалів. Відзначимо, що якщо в конфігурації іnsіde-out піпетковий електрод був "позаклітинним", а внутрішній - "внутрішньоклітинним", те тепер вони помінялися ролями. З погляду вивчення струму через канали, перевага цього методу полягає в тому, що тут залишаються цілими клітинні структури й регуляторні механізми. Але є й недолік - ми вимірюємо сумарний струм всіх каналів у клітині, а не струми через одиночні канали.
Конфігурація Outsіde-out
Вирішити цю проблему дозволяє конфігурація outsіde-out (зовнішня сторона зовні). Якщо після переходу в whole-cell mode повільно відводити піпетку від клітини, мембрана не відривається відразу, а починає витягуватися в трубку (це видно на фото).

Початкова фаза переходу з Whole-cell в Outsіde-out. Перехід в outsіde-out. Заключна фаза.
Мембранна трубка стала зовсім тонкою й майже невидимою ("протуберанець" у поверхні клітини - це невелика частина цитоплазми, що залишилася в мембранній трубці). У наступну мить трубка порветься, а мембрана зімкнеться на піпетці в "вивернутому" виді - ми опинемось в конфігурації "outsіde-out"
Perforated patch
Perforated patch ("перфорований patch") - це специфічний варіант patch-clamp в whole-cell mode. У цьому випадку, у піпетковому розчині утримується невелика кількість спеціального антибіотика. наприклад, граміцидина. Антибіотики цього класу формують іонні канали в клітинній мембрані на ділянці, приєднаній до мікропіпетки.
Такий підхід дозволяє уникнути заміщення внутрішнього середовища клітини розчином з піпетки-електрода, тобто клітина залишається живою з мінімальними, наскільки це можливо, ушкодженнями. Таким чином, відповіді клітки на подразники є максимально наближеними до природного. У той же час, даному методу властиве ряд недоліків. По-перше, у порівнянні із класичним whole-cell mode, електричний опір доступу (яке складається з опору піпетки й опору в місці з'єднання піпетки з мембраною) є значно більш високим. Це знижує якість фіксації потенціалу, підвищує рівень шуму при записі, і збільшує значення всіх помилок, пов'язаних зі змінами опору повного ланцюга (від електрода в зовнішньому розчині до електрода в піпетці). По-друге, для того, щоб антибіотик подіяв, потрібно досить багато часу (до 30 хвилин), що істотно зменшує корисний період експерименту. І, по-третє, антибіотик ушкоджує мембрану також й у місці з'єднання з кінчиком піпетки, що приводить до прискореного руйнування гігаомного контакту й додатково зменшує ефективний експериментальний час. Таким чином, даний варіант методу може бути з успіхом використаний тільки в експериментах, які не вимагають тривалого часу для виявлення досліджуваних явищ.
Nucleated patch
Цікавий різновид patch-clamp - nucleated patch. (Фіксація потенціалу із клітинним ядром).
Метод полягає в наступному. Піпетка підводить до клітини, а потім ривком пробиває мембрану. Після цього кінчик піпетки підводить до клітинного ядра, на піпетку подається невеликий негативний тиск. У результаті піпетка присмоктує до ядра. Потім піпетка з ядром на кінці плавно приділяється назад і виймається із клітини. Піпетку необхідно вивести із клітини таким чином, щоб ділянка мембрани в місці виходу "наділася" на ядро, що присмокталося, і відірвалася, обернувшись довкола нього. У результаті виходить специфічний варіант outsіde-out patch, при якому набагато більший, ніж у звичайному варіанті методу, ділянка мембрани приєднана до кінця піпетки, будучи обгорнутою навколо клітинного ядра.
Фіксація потенціалу й фіксація струму
Коли вивчаються зміни провідності однотипних каналів у відповідь на якісь хімічні впливи або залежність їхньої провідності від різниці потенціалів на мембрані, зручно фіксувати потенціал і вимірювати струм каналу - як ми дотепер й описували. Цей, найчастіший варіант patch-clamp, називається voltage clamp (фіксація потенціалу). Однак, іноді дослідника цікавлять процеси трансмембранного переносу іонів, пов'язані зі зміною мембранного потенціалу - наприклад, проведення нервового імпульсу. У таких випадках можна надійти протилежним образом: зафіксувати на постійному рівні струм, і вивчати зміни різниці потенціалів при цьому. Такий варіант називається current clamp (фіксація струму).
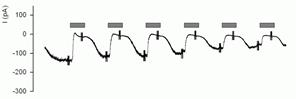
Приклади записів, одержуваних методом patch-clamp

Запис струму одиночного каналу (гліцинового рецептора)
Запис одиночного каналу рецептора гліцину. Чітко видно два стани: закрите (йому відповідає нульовий струм) і відкрите (йому відповідає струм приблизно в 7 пикоампер). Канал час від часу спонтанно переходить із одного стану в інше, проміжних станів немає. Запис дозволяє одержати дві найважливіші характеристики каналу: провідність (виходячи з величин трансмембранного потенціалу й струму) і ймовірність знаходження у відкритому стані (обумовлене як відношення часу, коли канал відкритий до часу, коли він закритий). До слова, найчастіше активність каналу фізіологічно регулюється шляхом зміни цієї ймовірності.