Реферат: Искусственный синтез олигонуклеотидов
1. Искусственный синтез олигонуклеотидов
Искусственный химический синтез заданной последовательности рибо- или дезоксирибонуклеозидов (типа РНК и ДНК).
Первый нуклеотид последовательности через его 5'-фосфатную группу химически закрепляют на твердой подложке, например, полистирола. Все потенциально химически активные группы и атомы его нуклеинового основания (аминогруппы, кислород) временно блокируются присоединением инертной «защиты». 3'-ОН группа сахара не блокируется.
Все нуклеотиды, подлежащие последовательному присоединению тоже заблаговременно защищаются не только по нуклеиновым основаниям, но и по 3'-ОН группе рибозы или дезоксирибозы. Активность фосфорной кислоты, присоединенной по 5'-положению сахара умеряется «навеской» хлорбензола по одному из ее кислородов. Таким образом, для реакции остается свободной только ОН-группа этой кислоты.
Теперь в реакционную среду вносят второй по заданному порядку нуклеотид последовательности — защищенный, как это было только что описано. В реакции между двумя ОН-группами отщепляется вода и устанавливается ковалентная фосфодиэфирная связь двух нуклеотидов. Затем снимается химическая защита с 3'-ОН группы только что присоединившегося второго нуклеотида и в реакционную среду вносят третий защищенный нуклеотид... И так далее. Разумеется, отщепление воды и образование фосфодиэфирной связи происходит не само собой, а в присутствии сложного химического катализатора реакции.
По окончании синтеза заданной цепочки олигонуклеотида все защиты снимаются и олигонуклеотид отделяется от твердой подложки.
Современные автоматические синтезаторы производят такую «сборку» олигонуклеотидов по заданной программе на длину до сотни нуклеиновых оснований.
Упомяну еще, что недавно найден способ наращивания искусственной цепи олигонуклеотидов с заменой химического катализатора на облучение этой цепи лучом лазера на каждой следующей ступени синтеза. Это упоминание вскоре нам пригодится.
Получив описанным способом отрезок одной нити нужного фрагмента ДНК, построение второй нити по нему, как по матрице, можно поручить ДНК-полимеразе.
1.1 Секвенаторы белков
Остается сказать несколько слов об еще одном автомате, предоставляющем в распоряжение исследователя необходимую для всего дальнейшего последовательность аминокислот в исходном белке. Первый вариант такого автомата был предложен еще в 1967 году Эрдманом и Беггом. Он настолько хорошо зарекомендовал себя, что в основных чертах сохранился до сих пор. Единственное, но не маловажное его улучшение состоит в том, что современные секвенаторы могут анализировать аминокислотную последовательность с обоих концов белковой молекулы (N-конца и С-конца), в то время, как цепь реакций, предложенных Эрдманом решала только первую из этих двух задач.
Упомянутая цепь химических реакций в деталях нам еще не доступна, поэтому я ограничусь общей словесной характеристикой ее 3-х этапов, обращая внимание на физическое состояние и характеристики реагентов.
На 1-м этапе некое сложное органическое вещество в водной, слегка щелочной среде присоединяется к исследуемому белку с его N-конца. На 2-м этапе оно отделяется от белка, «прихватив» с собой концевую аминокислоту. Этот этап приходится проводить в кислой безводной среде. В результате получается сложное и весьма гидрофобное производное концевой аминокислоты и укороченный на одно звено белок. Их можно разделить между собой переводя в такой органический растворитель, в котором укороченный белок выпадает в осадок, а модифицированная аминокислота в этом растворителе может быть выведена из прибора для ее дальнейшей (хроматографической) идентификации. .Перед началом следующего цикла осадок белка должен быть вновь растворен в водной, слегка щелочной среде.
Из сказанного ясно, что в ходе полного цикла реакции необходимо менять растворители, осаждать один из компонентов (белок), экстрагировать другой, промывать осадок, сушить его и снова растворять. Все эти операции по определенной программе удается осуществить с помощью быстро вращающейся (>1500 об/мин) стеклянной чашечки, которая служит реакционным сосудом (рис. 32).
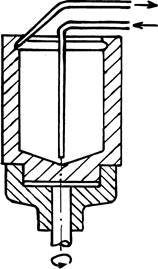
Рис. 32.
В нее вносят исходный препарат раствора белка. По центральной трубке на коническое дно чашечки один за другим подаются необходимые жидкие реагенты. Благодаря вращению они тонким слоем поднимаются по стенкам чашечки. Их количество и скорость вращения можно подобрать так, что слой не достигает канавки, выполненной в верхней части внутренней поверхности. Тонкая пленка прилегающей к стенке жидкости идеально подходит для экстракции из нее вещества в другую тонкую пленку. Ее образует не смешивающийся с предыдущей жидкостью органический растворитель, который поднимается по поверхности первой пленки. Здесь же осуществляется центрифугирование. На стенках чашечки оседают укороченные полипептидные цепи белка, в то время, как органический растворитель вымывает из реакционной смеси отщепившуюся гидрофобную производную очередной аминокислоты. Для этой цели растворитель подается в избытке, слой его поднимается до канавки, откуда через вторую трубочку раствор модифицированной аминокислоты поступает в коллектор фракций. Осажденный на стенки белок там же промывается и высушивается, а затем снова растворяется в слегка щелочной водной среде. Далее весь цикл повторяется...
За последующие годы прибор Эрдмана и Бегга был технически усовершенствован и переведен на компьютерный контроль, но первоначальный принцип его устройства сохранился.
2. Умножение количества индивидуального белка
Перспектива наработки большого количества индивидуального белка в качестве продукта деятельности вторгнувшегося с плазмидой в бактерию гена. Этот ген должен быть тем самым геном, который изначально кодировал синтез нужного нам белка. Только и всего! Но посмотрим, так ли просто получить этот ген, исходя только из наличия в нашем распоряжении самого белка? Будем решать эту задачу для белка животного происхождения. Здесь она в определенной мере сложнее ввиду сплайсинга иРНК и практически важнее. В ее решении явно просматриваются два этапа:
1) Получить индивидуальную иРНК, ответственную за синтез интересующего нас белка.
2) На базе этой иРНК создать двунитевую структуру ДНК, воспроизводящую если и не весь ген, то его «значащую» часть — ту совокупность последовательных участков, которые диктуют синтез соответствующих экзонов иРНК. Такой «рационально укороченный» ген можно встраивать в плазмиду. Он в бактерии-реципиенте обеспечит синтез полноценной иРНК, а вслед за ней и наработку нужного нам белка. Мне удобнее будет начать с этого второго этапа.
2.1 Воспроизведение «значащей» части гена по известной иРНК
Предположим, что мы располагаем достаточным количеством нашей индивидуальной иРНК. Рассмотрим последовательность операций, позволяющую произвести метаморфозу этой иРНК в соответствующую ей часть гена прямо в пробирке.
Нам известно, что иРНК животного происхождения на своем 3'-конце несет длинный «хвост» адениновых нуклеотидов (поли А).
1 этап. Добавим к раствору нашей иРНК в достаточном количестве олигонуклеотид длиной в десяток-другой дезоксириботи-мидинов (олиго дТ). Мы уже знаем, как его можно синтезировать. Олиго дТ может гибридизоваться с поли А. Создадим для этого оптимальные условия (буфер, концентрация соли, умеренно повышенная температура). Мы получим структуру, с которой начнется 2-й этап.
2 этап. Добавим в раствор нам еще не встречавшийся фермент — «обратную транскриптазу». В присутствии 4-х дезоксирибонуклеотидов этот фермент способен вести комплементарный синтез ДНК по матрице РНК в нормальном направлении от 3' к 5'-концу матрицы. Он тоже нуждается в праймере, каковым для него послужит уже сидящий на 3'-конце иРНК олиго дТ
3 этап. Обработаем полученный РНК-ДНК гибрид упомянутой ранее рибонуклеазой Н. Она как раз разрушает РНК, находящуюся в двунитевом гибридном комплексе с ДНК (см. там же). Однако поставим этот фермент в такие условия, чтобы наша иРНК была разрушена не до конца — остались небольшие ее участки.
4 этап. От этих участков, как от праймеров, начнет работать вносимая на этом этапе ДНК-полимераза I. Она, как нам известно, не только ведет матричный синтез ДНК, но и обладает S'-S* экзо-нуклеазной активностью. Благодаря этому она разрушает остатки иРНК и образует из синтезированных ею фрагментов, не без помощи все той же ДНК-лигазы, полноценную нить ДНК.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--