Реферат: Кальций – фосфорно – магниевый метаболизм
Роль кальция в жизни организма настолько велика, что неверно было бы просто сказать, что кальциевый метаболизм, как и всякий минеральный, регулируется клетками — и этим всё исчерпывается. Ведь множество интрацеллюлярных процессов, от митоза и рождения клеток, до апоптоза и их гибели — в свою очередь — регулируются кальцием, при участии специфически распознающих его белков (кальмодулина, кальэлектринов, кальпаинов и т.д.). От кальция зависит генерация потенциалов действия и электромеханическое сопряжение, передача гормонального сигнала и клеточная локомоция. Кальций регулирует и скорость жизненно важных внеклеточных процессов — например, свёртывания крови.
Все клетки — от примитивных одноклеточных организмов — до нейронов коры больших полушарий человека жизненно зависят от обмена кальция. По мнению К. и Ч. Р. Клеемен (1981), это связано с тем обстоятельством, что жизнь зародилась в среде первичного океана, богатой кальцием. Характерно, что паратироидный гормон впервые обнаруживается у наземных животных, переселившихся в среду, где кальций стал менее доступен. Будучи важным регулятором, ион кальция, в то же время, ядовит для клеток, и значительное повышение его внутриклеточной концентрации запускает механизмы клеточной гибели, участвуя в некробиозе и апоптозе. Внутри клеток концентрация кальция в 10000-100000 раз меньше, нежели снаружи. Поэтому, уровень кальция вне и внутри клеток подлежит прецизионному контролю, а при попадании в цитозоль кальций эффективно секвестрируется митохондриями и ЭПР.
Метаболизм кальция в организме тесно переплетён с обменом фосфатов, связывающих большую часть внеклеточного кальция в виде кристаллов гидроксиапатита (эмпирическая формула которого — Са10 (РО4 )6 (ОН)2 ), в композитных минерализованных структурах — костях. В организме около 2 кг кальция и более 1 кг фосфора. Это 2 его главных минеральных компонента. Из данного количества, 98% кальция и 85% фосфора связано в костях и зубах.
По мнениюГ.Кретцинджера (1978), именно роль фосфата, как ключевого участника энергетического метаболизма, главного внутриклеточного аниона, концентрации которого в клетках в 100 раз превышают наружные, предопределила биологический выбор кальция на роль убиквитарного регулятора, как и необходимость поддерживать на низком уровне внутриклеточный уровень этого катиона. Коль скоро клетки стали поддерживать кальциевый градиент, появилась возможность использовать его модуляцию в информационных целях.
Близкая физико-химическая аналогия двух щелочно-земельных катионов — Са2+ и Мg2+ привела к тесному переплетению их метаболизма. Магний — важный кофактор некоторых аденилатциклаз, фосфатаз и фосфорилаз, участник трансфосфорилирования, что связывает его судьбу в организме и с фосфором. Большая часть магния (60%) тоже депонирована в скелете.
Регуляция кальциево-фосфорно-магниевого гомеостаза
Судьба кальция и фосфора в организме отражена на рис.1.
Содержание кальция в диете нормируется и не должно быть менее 0,6 г за сутки. Обычно, у взрослых людей за сутки с пищей поступает 0,6-1 г кальция, но у любителей оздоравливающих пищевых добавок и витаминно-минеральных композиций этот показатель порой превышает 1,5 г. Кальций плохо всасывается в ЖКТ. Всего 125—200 мг в день абсорбируют двенадцатиперстная кишка и верхняя треть тощей. Интересно, что одновременно определённое количество данного иона (до 0,2 г в сутки) экскретируется в подвздошной кишке. Кальций выводится также почками (до 0,3 г в сутки) и, в малом количестве, потовыми железами (до 0,1 г/сутки). Менее 1% всего кальция находится в интерстициальной жидкости.
В плазме 40% кальция связано с белками, в основном, с альбумином (связанная форма кальция), 15% — с кислыми органическими анионами (комплексная форма кальция), а остальной кальций свободен. Процент связанного кальция (СвСа) может быть оценён по эмпирической формуле:
СвСа(%) = 0,8А (г/л)+0,2Г(г/л)+3
где: А — концентрация в плазме альбумина, а Г — глобулинов.
Количество общего кальция в плазме понижается при гипоальбуминемии, но это не оказывает влияния на содержание катиона кальция. Содержание ионизированного кальция в плазме находится в обратной зависимости от рН и от концентрации фосфат-аниона: гиперфосфатемия алкалоз способствуют появлению признаков гипокальциемии, хотя уровень общего кальция при этом не меняется. Ацидоз и гипофосфатемия, наоборот, повышают содержание ионизированного кальция в плазме.
Кальций экскретируется почками в количествах, составляющих, примерно, 0,15-0,3 г в сутки, причем этот процесс лишь при очень низких содержаниях кальция в диете определяется поступлением данного иона в организм. При нерезко сниженном, нормальном и избыточном насыщении диеты кальцием, между скоростью экскреции кальция с мочой и его содержанием в рационе нет строгого параллелизма. Поэтому, можно сказать, что собственно почечные механизмы, как сохранения кальция, так и выведения его избытка не обладают большой лабильностью. Они должны эффективно взаимодействовать с кишечными механизмами. Кальций реабсорбируется в почках в дисталъной части канальцев (15%) и, в ещё большей мере - в проксимальной части (60%) и петле Генле (25%).
Уровень ионизированного кальция в плазме регулируется взаимодействующими гормонами паратиреокринином и кальцитонином , а также витамином D . Под их контролем, приблизительно 0,5 г кальция в сутки у взрослого индивида обменивается между скелетом и плазмой крови.
Фосфор, в отличие от кальция, абсорбируется в ЖКТ, напротив, очень активно. С пищей, в среднем, в день поступает около 1,2 г фосфора. Для диагностики нарушений фосфорно-кальциевого обмена, концентрации фосфора в крови, следует определять натощак, так как, в отличие от уровня кальция, они растут после еды.
В тощей кишке всасывается до 90% суточного потребления фосфатов. Почки экскретируют 15% фильтрующихся фосфатов с мочой, в равновесном с поступлением этих ионов режиме. Фосфат может активно секретироваться в канальцах. Реабсорбция фосфата происходит на 9/10 — в проксимальных канальцах, а на 1/10 — в более дистальных частях нефрона.
В дополнение к 85% фосфора, депонированным, как уже отмечалось выше, в костях и зубах, мягкие ткани содержат существенную часть связанного фосфора и фосфат-аниона (до 14%). Всего 1% фосфора находится во внеклеточной жидкости. Макроэргические фосфатные соединения и фос-форилированные активные метаболиты в норме не могут свободно покидать клетки. Поэтому, только 12% фосфатов плазмы связано с белками, остальные представлены свободными фосфат-анионами. Уровень фосфора в плазме зависит от факторов, регулирующих обмен кальция.Но, кальциевый гомеостаз не является единственной детерминантой фосфорного обмена. Кроме этого, судьба фосфора определяется ходом энергетического метаболизма в клетках. В.С. Ильин, вообще, предпочитал говорить не о фосфорном, а об «углеводно-фосфорном обмене», имея в виду исключительную зависимость судьбы фосфата от катаболизма углеводов (1966). При активации синтеза гликогена фосфаты переходят внутрь клеток. Поэтому, глюкоза, инсулин, сахаристая пища — вызывают гипофосфатемию из-за перемещения фосфат-анионов в клетки. Алкалоз, особенно, дыхательный, также провоцирует гипофосфатемию, как полагают М.М. Горн и соавт. (1999), в силу активации клеточного гликолиза и образования фосфорсодержащих метаболитов глюкозы. Дыхательный ацидоз, после торможения гликолиза лактатом, наоборот, приводит к выходу фосфата из клетки и гиперфосфатемии. В силу этих некальциевых факторов, влияющих на уровень фосфора в плазме, концентрация фосфатов имеет чёткий суточный ритм, тогда как у ионизированного кальция такой пе-риодизм отсутствует. Низший уровень фосфатов в плазме наблюдается утром, а после полудня и ночью имеются 2 пика (М.Ф. Холик и соавт., 1994).
Процессы депонирования кальция и фосфора в костях и их абсорбции/экскреции в кишечнике и почках взаимно сбалансированы так, что концентрация этих ионов в крови изменяется в весьма узких пределах (8,8-10,4 мг/дл или 22-26 мМ/л кальция и 2,5-4,5 мг/дл или 9-13 мМ/л фосфата).
Магний — преимущественно, внутриклеточный катион, четвертый по абсолютному содержанию в организме (Л.Г.Смит, 1987). Тело взрослого человека содержит около 25 г магния. В интрацеллюлярной жидкости его концентрация в 8 раз выше, чем в интерстициальной. Взрослому человеку в день нужно не менее 3,5—4,5 мг магния, чтобы не расходовать его костные резервы. Богаты магнием зелень, где он выполняет ключевую роль при фотосинтезе в составе хлорофилла, морепродукты и мясо, орехи и семечки, бобовые, бананы и цитрусовые, шоколад, патока и кокосы. Впрочем, если этих разносолов на столе нет, полезно помнить, что очень богаты данным металлом маковые зерна, а также самый обыкновенный... чай.
Магний всасывается в тонком кишечнике, при участии витамина D, примерно на 40% от его поступления с пищей. Избыток фитиновой кислоты и жирных кислот, а также алкоголь отрицательно влияют на его абсорбцию. Высокие концентрации магния в кишечном содержимом мешают всасыванию кальция, но не наоборот. Магний экскретируется почками, причём эффективность его реабсорбции может достигать 95%. Почки варьируют экскрецию магния в равновесном, по отношению к поступлению этого электролита, режиме, в широчайшем диапазоне — от 1 до 250 мМ в день. Алкоголь препятствует реабсорбции магния в нефронах. Кальций и магний конкурируют при реабсорбции. Магний — составная часть минерального вещества костей, участник работы трансфосфорилирующих ферментов и амино-ацил-т-РНК-синтетаз, обеспечивающих условия для трансляции белков. В электрофизиологических процессах определённое значение имеет роль магния, как антагониста кальция, проявляющаяся в их различном влиянии на ЦНС.
Центральные органы, регулирующие кальций-фосфорно-магниевый обмен — паратиреоидные железы.
В гистологии данные органы называются околощитовидными или паратиреоидными.
Нижние паращитовидные железы возникают из того же третьего глоточного кармана, который дают начало и тимусу (см. выше), а верхние являются дериватами четвёртого глоточного кармана. Таким образом, у верхних и нижних полюсов каждой из долей щитовидной железы, вне капсулы последней, но под её фасцией, в норме, обнаруживается по одной паращитовидной железе.
Однако, топография данного эндокринного органа, быть может, наиболее изменчива среди всех эндокринных желез. У очень значительной части людей (более 10%) дополнительные паращитовидные тельца обнаруживаются по всему ходу эмбриональной миграции глоточных карманов: в том числе, в тимусе, переднем средостении, близ каротидных артерий. Они служат нередко источником эктопических гормонообразующих опухолей.
Паращитовидные железы — наиболее «молодое» органное открытие эндокринологов. Верхние наружные паращитовидные железы впервые описал шведский анатом И.К. Сундстрём, только в 1880 г.
Паращитовидные железы состоят из капсулы, стромы и недольчатой паренхимы, в которой представлены мелкие главные клетки двух подвидов: тёмные, содержащие секреторные гранулы и, вероятно, покоящиеся; и светлые — лишённые таких гранул и секреторно активные, последние также богаты гликогеном. В железе имеются также более крупные оксифильные клетки, появляющиеся, очевидно, путём трансформации главных в период пубертата и с возрастом всё более многочисленные. Оксифильные клетки рассматриваются как результат инволюции главных. Функция оксифильных клеток точно не известна доныне. По последним данным, парат-гормон может синтезироваться и в них.
Главные клетки обладают очень развитым гладким эндоплазматическим ретикулюмом (ГЭР), в оксифильных ГЭР представлен слабее. Оксифильные клетки богаты, а главные — относительно бедны митохондриями. Интересная особенность нормальной структуры паращитовидных желез — наличие в каждой из них большого количества жира, накапливаемого с возрастом (у пожилых — до 70% объема желез). При гиперплазии и опухолях количество жира в паращитовидных железах резко снижается.
Основной продукт паращитовидной железы — паратиреокринин (прежние названия — паратирин или парат-гормон). Структуру паратироидного гормона расшифровали в 1970 г. Х.Д.Найел и соавторы. Его выделяют главные клетки.
Парат-гормон — это пептидный регулятор, (рис. 2), состоящий из 84 аминокислот (молекулярной массой чуть более 9,5 кД).
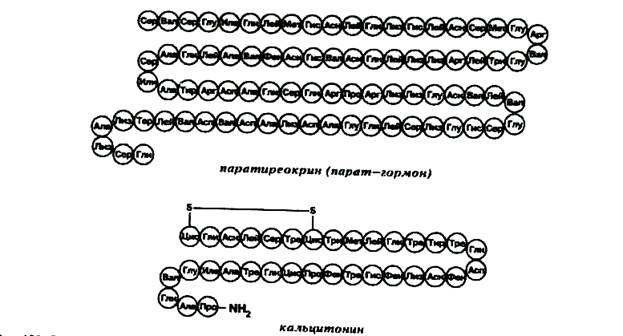
Рис. 2. Структура парат-гормона и кальцитонина человека.
Парат-гормон возникает из препрогормона длиной в 131 аминокислотный остаток (молекулярной массой около 12,5 кД, синтезируется на полисомах), через стадию прогормона (90 аминокислот, образуется в ЭПР под действием клипазы), причем его процессинг модулируется ферментом фурином. Прогормон поступает за счет энергозависимого механизма в комплекс Гольджи, где протеолитический мембранно-связанный комплекс (триптическая клипаза) вычленяет из него активный гормон. Препрогормон кодируется в 11 -и хромосоме, а фурин — в 15-й. Оба экспрессируются совместно. Весь процесс синтеза и секреции (которая может происходить как в виде экзоцитоза специальных гранул, так и в безгранулярном режиме.) занимает около 30 мин., причём 15 мин. тратится на упаковку готового гормона в гранулы.
Паратиреоидная секреция активируется, в основном, в ответ на снижение концентрации ионизированного (свободного) кальцияв крови. Опосредованно, гиперфосфатемия также активирует паращитовидные железы, снижая концентрацию ионизированного кальция. Также, как кальций, но значительно слабее, на секрецию парат-гормона влияет и магний. Однако тяжелая длительная гипомагниемия парадоксальным образом подавляет секрецию парат-гормона, так как магний необходим самим паратиреоцитам для выделения их гормонов (см. ниже). Главные клетки располагают кальциевым сенсором — трансмембранным гликопротеином, вмонтированным в их плазматическую мембрану. Таким же сенсором обладают, кроме паратироцитов, С-клетки щитовидной железы и некоторые клетки мозга и почек. Этот рецептор кодируется в хромосоме 3, при повышении уровня экстрацеллюлярного ионизированного кальция он блокирует экспрессию генов гормона паращитовидных желез и ключевого фермента его активации. В настоящее время доказано, что выработка парат-гормона, преимущественно, регулируется in vivo на посттранскрипционном уровне. При повышении уровня иона кальция в крови происходит стимуляция рецептора, активация пострецепторного Сq-белка и нарастание концентрации кальция в цитозоле, блокирующее функцию главных клеток. Мутации данного сенсора дают при гомозиготности тяжелый наследственный неонатальный гиперпаратиреоз, а у гетерозигот — доброкачественную семейную гипо-кальциурическую гиперкальциемию (см. ниже).
Кальциевый сенсор может модулировать не только быстрый выброс из клеток готового гормона. Установлено, что к кальцию чувствительны протеазы, разрушающие в норме около 90% образующегося паратиреокринина. Таким образом, изменяя их активность, кальциевый сигнал способен влиять на долговременный пул гормона, через скорость его разрушения. При избытке кальция возможна, практически, полная деградация парат-гормона в главных клетках под действием нейтральных кальций-зависимых протеаз, с секрецией его неактивных С-концевых пептидов.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--