Реферат: Характеристика химического состава организма
Организм человека имеет следующий химический состав: вода -60-65%, органические соединения - 30-32%, минеральные вещества - 4%.
Наибольшее значение для живых организмов имеют органические соединения. Важнейшими классами органических соединений, входящих в живые организмы, являются белки, нуклеиновые кислоты, углеводы и липиды.
БЕЛКИ
Белки выполняют в организме очень важные функции. К ним в первую очередь следует отнести: структурную, каталитическую, сократительную, транспортную, регуляторную, защитную, а также энергетическую. На долю белков в среднем приходится 1/6 часть от массы тела человека.
По строению белки - это высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. В состав белковых молекул могут входить десятки, сотни и тысячи остатков аминокислот. Однако все белки, независимо от происхождения, содержат лишь 20 видов аминокислот Строение 20 разновидностей аминокислот, входящих во все белки, можно отразить следующей формулой:
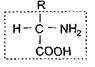
У всех аминокислот можно выделить общую, одинаковую часть молекулы, содержащую амино- и карбоксильную группы (выделена пунктирной рамкой). Другая же часть молекулы, обозначенная как радикал (R), у каждой из 20 аминокислот имеет специфическое строение, и аминокислоты отличаются друг от друга только радикалами.
Аминокислоты, соединяясь друг с другом пептидной связью, образуют длинные неразветвленные цепи - полипептиды. Пептидная связь возникает при взаимодействии карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты с выделением воды:
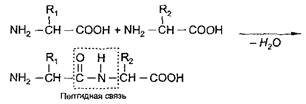
Пептидные связи обладают высокой прочностью, их образуют все аминокислоты.
В состав белковой молекулы входит один или несколько полипептидов.
Кроме пептидных, в белках обнаруживаются еще дисульфидные, водородные, ионные и другие связи.
Эти химические связи могут возникать между остатками аминокислот, которые входят в разные участки одного и того же полипептида или же находятся в разных полипептидах, но обязательно пространственно сближены. В первом случае благодаря таким связям полипептидная цепь принимает определенную пространственную форму. Во втором случае с помощью непептидных связей полипептиды объединяются в белковую молекулу.
В итоге молекула белка является объемным, трехмерным образованием, имеющим определенную пространственную форму. Для удобства рассмотрения пространственного строения молекулы белка условно выделяют четыре уровня ее структурной организации.
Первый уровень пространственной организации белковой молекулы называется первичной структурой и представляет собой последовательность расположения аминокислот в полипептидных цепях. Фиксируется эта структура прочными пептидными связями. Другими словами, первичная структура характеризует химическое строение полипептидов, образующих белковую молекулу. Каждый индивидуальный белок имеет уникальную первичную структуру.
Второй уровень пространственной организации - вторичная структура - описывает пространственную форму полипептидных цепей. Например, у многих белков полипептидные цепи имеют форму спирали. Фиксируется вторичная структура дисульфидными и различными нековалентными связями.
Третий уровень пространственной организации - третичная структура - отражает пространственную форму вторичной структуры. Например, вторичная структура в форме спирали, в свою очередь, может укладываться в пространстве в виде глобулы, т. е. имеет шаровидную или яйцевидную форму. Стабилизируется третичная структура слабыми нековалентными связами, а также дисульфидными связями и поэтому является самой неустойчивой структурой.
Пространственная форма всей белковой молекулы получила название конформация. Поскольку в молекуле белка наряду с прочными ковалентными связями имеются еще менее прочные (нековалентные) связи, то его конформация характеризуется нестабильностью и может легко изменяться. Изменение пространственной формы белка влияет на его биологические функции. Конформация, находясь в которой белок обладает биологической активностью, называется нативной. Любые воздействия на белок, приводящие к нарушению этой конформации, сопровождаются частичной или полной утратой белком его биологических свойств. Изменение конформации в небольших пределах обратимо и является одним из механизмов регуляции биологических функций белков в организме.
Четвертичной структурой обладают только некоторые белки. Четвертичная структура - это сложное надмолекулярное образование, состоящее из нескольких белков, имеющих свою собственную первичную, вторичную и третичную структуры. Каждый белок, входящий в состав четвертичной структуры, называется субъединицей. Например, белок крови гемоглобин состоит из четырех субъединиц двух типов (а и Р) и имеет строение а2 рг- Ассоциация субъединиц в четвертичную структуру приводит к возникновению нового биологического свойства, отсутствующего у свободных субъединиц. Например, формирование четвертичной структуры в ряде случаев сопровождается появлением каталитической активности, которой нет у отдельных субъединиц.
Объединяются субъединицы в четвертичную структуру за счет слабых нековалентных связей, и поэтому четверичная структура неустойчива и легко диссоциирует на субъединицы. Образование и диссоциация четвертичной структуры является еще одним механизмом регуляции биологических функций белков.
Из всех структур белка кодируется только первичная. За счет информации, заключенной в молекуле ДНК, синтезируются полипептидные цепи (первичная структура). Высшие структуры (вторичная, третичная, четвертичная) возникают самопроизвольно в соответствии со строением полипептидов.
Классификация белков
Белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. К простым белкам, имеющимся в организме человека, относятся альбумины, глобулины, гистоны, белки опорных тканей. В молекуле сложного белка, кроме аминокислот, еще имеется неаминокислотная часть, называемая простетической группой. В зависимости от строения простетической группы выделяют такие сложные белки, как фосфопротеиды (содержат в качестве простетической группы фосфорную кислоту), нуклеопротеиды (содержатнуклеиновую кислоту), гликопротеиды (содержат углевод), липопротеиды (содержат липоид), хромопротеиды (содержат окрашенную простетическую группу) и др.
Возможна и другая классификация белков, вытекающая из их пространственной формы. В этом случае белки разделяются на два больших класса: глобулярные и фибриллярные.
Молекулы глобулярных белков имеют шарообразную или эллипсоидную форму. Примером таких белков являются альбумины и глобу линыплазмы крови.
Фибриллярные белки представляют собою вытянутые молекулы, у которых длина значительно превышает их диаметр. К таким белкам прежде всего необходимо отнести коллаген - самый распространенный белок у человека и высших животных, на долю которого приходится 25-30% от общего количества белков организма. Коллаген обладает высокой прочностью и эластичностью. Этот белок широко распространен в организме, он входит в состав соединительной ткани, и поэтому его можно обнаружить в коже, стенках сосудов, мышцах, сухожилиях, хрящах, костях, во внутренних органах.
НУКЛЕИНОВЫЕ КИСЛОТЫ
По своему строению нуклеиновые кислоты являются полинуклеотидами, состоящими из очень большого количества мононуклеотидов (нуклеотидов). Любой нуклеотид обязательно включает в себя азотистое основание (циклическое соединение, содержащее атомы азота и обладающее щелочными свойствами), углевод и фосфорную кислоту.
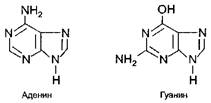
Азотистые основания бывают двух типов: пуриновые и пиримидиновые.
К пуриновым основаниям относятся аденин и гуанин, имеющие следующее строение:
--> ЧИТАТЬ ПОЛНОСТЬЮ <--