Реферат: Химическая кинетика и равновесие
Существуют 2 вида катализаторов :
гомокатализаторы;
гетерокатализаторы.
Биологические катализаторы – ферменты .
Ингибиторы – вещества, замедляющие ![]() химической реакции.
химической реакции.
Промоторы – вещества, усиливающие действие катализаторов.
Реакции, которые протекают только в одном направлении и идут до конца – необратимые (образование осадка, выделение газа). Их мало.
Большинство реакций – обратимые : 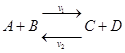 .
.
Согласно закону действия масс: ![]()
![]()
![]() – химическое равновесие .
– химическое равновесие .
Состояние системы, в которой ![]() прямой реакции =
прямой реакции = ![]() обратной реакции, называется химическим равновесием .
обратной реакции, называется химическим равновесием .
![]()
![]()
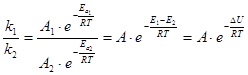 .
.
С увеличением температуры, ![]() : для эндотермической реакции возрастает, для экзотермической реакции убывает для
: для эндотермической реакции возрастает, для экзотермической реакции убывает для ![]() остаётся постоянным.
остаётся постоянным.
Влияние различных факторов на положение химического равновесия определяется принципом Ла-Шателье : если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
В состоянии равновесия ![]() .
.