Реферат: Химическая кинетика
рассчитываются искомые величины:
Ea = 12064∙R = 12064∙8,314 = 100300 Дж/моль,
k0 = e36,729 = 8,94 ∙ 1015 .
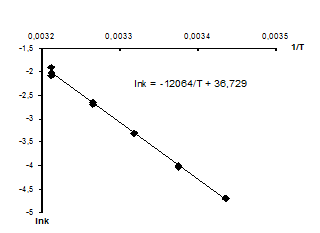
Рисунок – Нахождение коэффициентов уравнения Аррениуса
Для некоторых химических реакций, особенно в органической химии, даже при больших долях активных молекул скорость реакций оставалась незначительной. Теория активных столкновений объясняет это особенностями столкновения молекул.
3 Молекулы перед столкновением должны быть сориентированы друг относительно друга определённым образом.
Нужный вариант относительной ориентации приводит к реакции, в противном случае взаимодействия не происходит. Из термодинамики известно, что функция, характеризующая беспорядок в системе (движение молекул), – это энтропия. В соответствии с третьим положением теории уравнение Аррениуса было преобразовано:
![]() .
.
В этом уравнении Sa – энтропия активации химической реакции. Энтропия активации, как и энергия активации, может быть найдена из экспериментальных данных.
Катализ
Катализ – изменение скорости химической реакции в присутствии веществ, называемых катализаторами, которые, вступая во взаимодействие с реагентами, сами к концу реакции остаются химически неизменными.
Все важнейшие промышленные процессы протекают в присутствии катализаторов. В живых и растительных системах протекает громадное количество каталитических реакций. При этом увеличение скорости под действием катализаторов может достигать миллионов раз.
Общие свойства каталитических реакций:
1 Участие катализатора в реакции не отражается на её химическом уравнении. Однако скорость реакции пропорциональна количеству катализатора.
2 Катализатор обладает специфичностью действия. Он может изменять скорость одной реакции и не влиять на скорость другой.
3 Катализатор не смещает химического равновесия, так как он в равной мере изменяет скорость и прямой, и обратной реакции.
4 Некоторые вещества усиливают действие катализатора (промоторы), другие – ослабляют (яды).
Различают положительный и отрицательный катализ. Положительный катализ называют просто катализом, отрицательный – ингибированием.
Катализ бывает гомогенным и гетерогенным. Гомогенный катализ наблюдается в том случае, когда катализатор и реагенты находятся в одной фазе. Примерами гомогенного катализа являются реакции в водных растворах в присутствии кислот или щелочей.
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Большая часть каталитических реакций протекает в гетерогенных системах на твёрдых катализаторах.
Механизм действия катализатора может быть отражён следующей схемой:
1 А + В = АВ без катализатора;
2: а) А + К = АК;
б) АК + В = АВ + К с катализатором.
Видно, что катализатор сначала связывается с одним из веществ в нестойкое соединение, а затем второй реагент вытесняет его из этого соединения.
Существующие в настоящее время представления о влиянии катализатора на скорость химической реакции объясняют увеличение скорости тем, что катализатор уменьшает энергию активации и (или) увеличивает энтропию активации химической реакции.