Реферат: Хімічна біотехнологія
Ендоамілази – це α-амілази. Які розщеплюють α-1,4-глюкозидні зв’язки амілазі і амілопектині з утворенням олігосахаридів з різної довжини ланцюгами і α-конфігурацією при С1 атомі глюкози. Для зрідження крохмалю при високій температурі використовують термостабільні α-амілази. Наприклад амілази Bacilluslicheniformis температурний оптимум лежить при 92 єС. Для зрідження крохмаль диспергують у воді при нагріванні, для зменшення в’язкості і для запобігання осіданню крохмалю при охолодженні проводять частковий його гідроліз. При одностадійному розрідженні фермент добавляють на самому початку, до приготування суспензії, яке проводять при 150 єС на протязі 5 хвилин, після чого гідроліз ведуть 2 години при 95 єС.
При кисло-ферментному зрідженні фермент після желатинування крохмалю, викликаного нагріванням.
Сиропи, що добувають з крохмалю, містять багато мальтози (40-50%). Знаходять застосування в виробництві карамелі і заморожених десертів.
Екзоамілази розщеплюють α-1,4-глюкозидні зв’язки, α-глюкогенні амілази гідролізують α-1,6-глюкозидні зв’язки в розгалужених молекулах олігосахаридів. Для промислових цілей Глюкоамілази отримують із Aspergillusniger або Risopussp. Це низько специфічні ферменти, які гідролізують зв’язки α-1,3 і α-1,6 повільніше ніж α-1,4. Вони стабільні в широкому діапазоні рН і більш активні при 75 єС, хоча частіше функціонують при 65 єС. В препаратах цих ферментів присутні забруднюючі домішки трансглюкозилази, яка каталізує утворення олігомерів глюкози, що не зброджуються. Це може суттєво понижувати вихід глюкози.
Глюкоамілази застосовуються в основному в виробництві концентрованого сиропу (90-97% D-глюкоза), з якого отримують кристалічну глюкозу. Також вони застосовуються при виробництві сиропів з високою ступінню конверсії (35-43% глюкози, 30-37% мальтози і 8-13 % мальтотріози) для харчової промисловості.
3.Застосування інших ферментів, що важливі для комерції.
Сьогодні ферменти застосовуються найбільш широко для перетворення вуглеводів, які відіграють особливу роль в харчовій і молочній промисловості.
Глюкозоізомераза.Каталізує перетворення глюкози у фруктозу. Комерційні препарати її відомі під фірмовою назвою „Sweetyzyme“ або „Maxazyme”. Їх поява стала поштовхом для розвитку крупного виробництва фруктового соку. При високих концентраціях субстрату і нейтральних рН несолодка глюкоза з виходом 42-47 % ізомеризується ферментом в більш солодку фруктозу. Запатентовано багато способів іммобілізації і використання як самої ізомерази так і клітин, які її містять. Процес іде при 60-65 єС, при рН 7,0-8,5 в присутності іонів магнію.
Я-галактозидазу (лактазу) застосовують для гідролізу лактози в збираному молоці. Безлактозний продукт, що отримують, іде для харчування тих людей, організм яких не розщеплює лактозу.
Під дією лактази з сахарози отримують глюкозу. На комерційний рівень поставлено ферментативне розділення рацематних сумішей амінокислот і ефірів, які утворюються при хімічному синтезу.
Ряд ферментів грає роль i в медичній діагностиці. Так, холестериноксидаза дозволяє визначити рівень холестерину в сироватці крові,
а уреаза - рівень сечової кислоти. В дослідженнях генної інженеріївикористовують рестрикційні ендонуклеази, які розрізають ДНК, і лігази, які зшивають розрізані кінці ДНК.
Групі американських дослідників на чолі з Девісом (Медична школа Стенфордського університету) вдалося підвищити вихід лігази
в 500 разів за рахунок введення декількох копій лігазного гену в клітини Е. coli.
Пренатальну діагностику серповидноклітинної анемії можна здійснити, обробляючи рестрикційними ендонуклеазами ДНК зародкових клітин амніотичної рідини замість того, щоб відбирати проби крові зародка. Отримані мікробіологічним шляхом ферменти можуть також знайти важливе значення у виробництві пластмас.
4.Технологія іммобілізованих ферментів
В промисловості вже на початку 80 було реалізовано 4 широкомасштабні технології на основі іммобілізованих ферментів(глюкозоізомерази, аміноацилази, пеніцилази і лактази). Але ще на початку 20 століття було відомо, що деякі ферменти, якщо їх адсорбувати на твердому носії (такому, як вугілля або силікагель), зберігають свою каталітичну активність.
Іммобілізація – поняття досить широке. Воно означає просте зв’язування ферментів з нерозчинними в воді носіями, а також будь-яке обмеження ступенів свободи ферментних молекул і їх фрагментів. Наприклад лактазу іммобілізують на частках кремнезему, застосовують для конверсії лактози сироватки в глюкозу і галактозу.
В майбутньому будуть використовуватись іммобілізовані ферменти. Їх можна використовувати в наступних цілях: а ) холінестераза може застосовуватись для визначення пестицидів; б) інші ферменти аналогічним способом можуть застосовуватися для визначення токсичних речовин, наприклад, гексокіназа дуже чутлива до малих концентрацій ліндану; в)іммобілізована гепариназа може застосовуватись для запобігання тромбоутворень в апаратах штучного кровообігу; г) іммобілізована білірубіноксидаза може бути застосована для видалення білірубіну із крові новонароджених, які страждають на гепатит; д) іммобілізовані ферменти знайдуть подальше застосування в молочній промисловості. При виробництві сиру можуть використовуватись іммобілізовані білки, які згортують молоко – ренін пепсин; е) Можливо, вдасться створити системи із декількох іммобілізованих ферментів. Наприклад якщо заключити в мікро капсули три ферменти – уреазу, глутаматдегідрогеназу і глюкозодегідрогеназу, то їх можливо використати для видалення сечовини із крові хворих на ниркову недостатність; є) різноманітні іммобілізовані ферменти з часом знайдуть застосування в датчиках для швидкого аналізу. Особливо корисними із-за їх високої стабільності можуть виявитись ферменти термофілів.
Іммобілізація ферментів дає наступні переваги: зростання стабільності біотехнологічних процесів, оптимізацію рН для каталітичної активності, отримання більш чистої продуктів реакції, полегшення відновлення і повторного використання біокаталізаторів, пониження інгібування ферментів.
Іммобілізація також дозволяє зупинити реакцію на будь-якій стадії, отримати продукт очищений від ферменту, що дуже важливо в ряді харчових і промислових виробництв.
Як же проходить іммобілізація? Ферменти закріплюють в просторі по-різному, декількома способами. Їх можна адсорбувати на кераміці, склі, силікагелі, оксидах і гідроксидах металів, полісахаридах, органічних смолах і інших носіях. Адсорбція при цьому здійснюється фізичними або іонними силами взаємодії. Поширені також методи механічного включання ферментів в полімерні гелі, в напівпроникні полімерні мікро капсули, в повні волокна, в рідкі мембрани. Особливий інтерес мають способи, які дозволяють приєднувати ферменти до неорганічних носіїв за допомогою хімічних (ковалентних) зв’язків. Можливе таке прикріплення ферментів до нейлону, полістиролу, поліакриламіду, іонообмінних смол.
Після закріплення на поверхні носія ферменти необхідно стабілізувати. Справа в тому, що вони є поживою для мікроорганізмів. Тому ферменти захищають від них, наприклад стінками мікропористого носія. Існують і інші способи стабілізації ферментів, коли молекули білку попередньо зв’язують „поперечними містками”, а потім вже прикріплюють хімічними зв’язками до твердого матеріалу і механічно включають утворення що дістали в тісні пори носія. Зафіксований таким чином фермент може працювати в різних умовах, зберігаючи активність при підвищених температурах і в відносно агресивних середовищах.
Також ефективним методом є іммобілізація не тільки ферментів, але й мікроорганізмів. Використання таких іммобілізованих клітин дає ряд переваг: не потрібно виділяти і очищати ферменти, невеликі витрати на виділення і очистку продуктів реакції, можливе створення наполовину безперервних і автоматизованих процесів.
ІІ. Біотехнологія і виробництво хімічних речовин
1.Біотехнологія виробництва розчинників
До числа важливих виробництв розчинників на основі бродильних процесів відноситься добування ацетону і бутанолу. Вперше в промисловому масштабі вони були здійснені Вейсманом в місті Манчестері в роки першої світової війни. Низькоякісний ацетон виробляли з деревини, але коли став потрібен високоякісний ацетон, то був заснований бродильний процес на переробці крохмалю (концентрацією в 3,8 %) анаеробними спороутворюючими бактеріями Clostridiumacetobutilicum. Перетворенню підлягає до 30 % субстрату в результаті чого утворюється суміш розчинників (60% бутанолу, 30 % ацетону і 10-15 ізопропанолу, етанолу). Залишок субстрату перетворювався на вуглекислий газ і водень (рис.1).
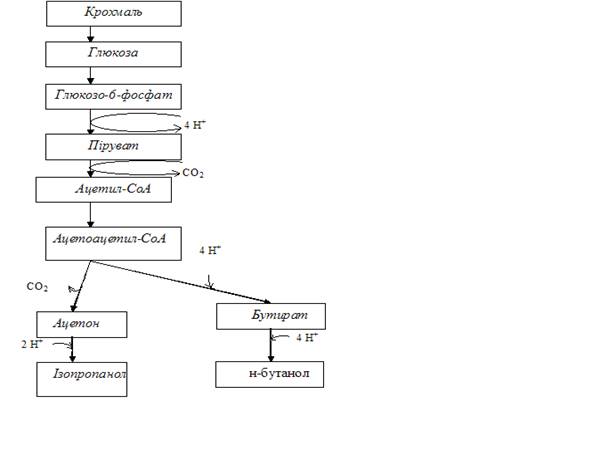
Рис.1. Схема реакцій ацетон-бутанольного бродіння
Оскільки утворювались великі об’єми газів при великомасштабному виробництві перемішування не було потрібно. Головні проблеми заключались в гасінні піни. В залежності від штамів відношення ацетон : спирт дещо варіювало. Розчинники відокремлюють від середовища перегонкою.
Велике значення має виробництво бутанолу. Його використовують при добуванні широкого кола речовин, включаючи гальмівну рідину, пластифікатори, карбамідну смолу, речовини з властивостями екстракції і добавки до бензину.(Сассон Альбер )
Після війни бродильне виробництво цих речовин скоротилось, так як відносна вартість нафтопродуктів, порівняно з вуглеводами, була нижчою. В наш час знову з’являється зацікавленість до ферментативного виробництва цих речовин.
Також цікавим отримання бутилен-2,3-гліколю за допомогою мікробіологічної конверсії. Для цього можна використати молочну сироватку. Вона може бути джерелом вуглецю при утворенні бутиленгілколю бактеріями Klebsiellapneumoniae або Enterobacteraerogenes. Бутиленгліколь потім йде на виробництво каучуку.
2.Виробництво органічних кислот.