Реферат: хіміко-технологічна система
Необхідно відзначити, для аналізу протікання стехіометрично незалежних реакцій використовуються термохімічні, термодинамічні і міжфазові балансові співвідношення. Термохімічні балансові співвідношення надають відомості про зміну ентальпії при протікання хімічних реакція в окремих або елементах всієї ХТС в цілому, про кількість теплоти, що виділяється при екзотермічних реакціях і поглинається при ендотермічних реакціях, що визначає вибір режимів апаратури і структури ХTC.
Термодинамічні балансові співвідношення, оскільки баланси складаються для стаціонарних станів, дають можливість кількісного визначення рівноважних складів реакційних сумішей.
Для цього необхідно визначення величину ізобарно-ізотермічного потенціалу відповідно до рівняння Гиббса:
![]() ,
,
де ΔН – ентальпія системи;
Т - температура;
ΔS - ентропія.
Кількісно визначити рівноважний склад реакційної суміші, слід визначати виходячи з константи рівноваги реакції, яка може бути знайдена з рівняння:
![]() ,
,
де – ΔG - зміна стандартного ізобарно-ізотермічного потенціалу; R –газова константа.
Міжфазові балансові співвідношення дають відомості про рівновагу в гетерогенних системах. Для цього використовуються правило фаз, закон розподілу речовин між фазами, діаграми фазової рівноваги, що дозволяють знайти склад фаз і їхні властивості: агрегатний стан, температура плавлення, кипіння, пружність пари і ін.
У результаті рішення приведених вище балансових співвідношень одержують дані, необхідні для складання матеріальних і теплових балансів окремих елементів у ХТС. Такі баланси часто називають ентальпійними, оскільки в них для визначення складу реакційних сумішей, кількості поглиненого чи виділеного тепла, у відповідності до першого закону термодинаміки виходять зі зміни ентальпії системи.
Інформацію, що дозволяє більш повно обґрунтувати вибір процесу і провести його порівняння з іншими, можна одержати при застосуванні поряд з ентальпійним, термодинамічного аналізу, зокрема, ексергетичного.
Ексергія характеризує корисну роботу, яку може зробити система у відповідності з другим законом термодинаміки, відповідно до якого не всі процеси можуть протікати в напрямку, зворотному його природному ходу. Або, що є таким самим, ексергія – це енергія, що при участі заданого навколишнього середовища, може бути перетворена в іншу форму енергії.
Використання ексергії дає можливість при оцінці в порівнянні ефективності різних процесів, враховувати не тільки кількість потоків енергії, але і їхню якість, тобто здатність енергії до здійснення корисної роботи.
Питома ексергія потоку речовини, виходячи з другого закону термодинаміки, буде:
![]()
де Н, S – ентальпія та ентропія речовини в аналізованому стані. відповідно;
Н0, S0 – ентальпія та ентропія речовини в стані термодинамічної рівноваги з навколишнім середовищем. Т – температура навколишнього середовища.
Величина ексергіі знаходиться за допомогою відомих параметрів стану – ентальпії і ентропії.
При цьому втрати ексергії в адіабатній системі визначаються здобутком температури навколишнього середовища на збільшення. ентропії внаслідок необоротності процесу. Вони будуть дорівнювати
![]()
Критерієм термодинамічної ефективності процесу служить ексергетичний коефіцієнт корисної дії, що у загальному виді може бути представлений як:
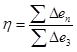
де ![]() – вироблена ексергія;
– вироблена ексергія;
![]() –витрачена ексергія.
–витрачена ексергія.
Висновок
Отже, ексергетичний аналіз дає можливість оцінки досконалості процесів і показує границі їхнього поліпшення. В даний час найбільш ефективно вирішується проблема використання енергії в енерготехнологічних системах, для яких характерна сувора збалансованість виробництва і споживання енергії, засновані на використанні теплоти екзотермічних реакцій і вторинних енергетичних ресурсів.
Література