Реферат: Комплексометрическое титрование, комплексоны, комплексонометрия, комплексонометрические ТКТ и индикаторы
E(OX/Red) = E(OX/Red) +![]()
где E(OX/Red) - реальный или равновесный редокс-потенциал, В; E(OX/Red) - стандартный редокс-потенциал, равный равновесному при а(ОХ) = а(Red) = 1 моль/дм3;
R - универсальная газовая постоянная (8,31 Дж/Кмоль);
Т - абсолютная температура, K; F - число Фарадея (96500 Кл/моль);
z - число электронов, участвующих в редокс-переходе в ОХ+ze - dRed; a(OX) и a(Red) - активности соответственно окисленной и восстановленной форм вещества, моль/дм3.
При подстановке в уравнение Нернста значений R, F и T = 298 К, а также переходе к десятичному логарифму, получим
E(OX/Red) =E(OX/Red) + 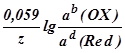 ,
,
так как а = γc, то
E(OX/Red) =E(OX/Red) + ![]() .
.
Обозначив первые два слагаемых в последнем уравнении E(1) (OX/Red), получим
E(OX/Red) =E(1) (OX/Red) + 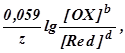
где E(1) (OX/Red) - формальный потенциал, характеризующий редокс-пару, у которой [OX] = [Red] =1 моль/дм3. E=E(1), если ионным взаимодейстием между ОХ и Red можно пренебречь. Обычно это возможно при концентрациях ОХ и Red меньше 0,1 моль/дм3. Редокс-потенциал зависит также от кислотности среды, комплексообразования или осаждения одного из компонентов редокс-пары в процессе редокс-перехода. Чем больше концентрация ионов водорода в растворе, тем больше окислительная способность окисленной формы вещества редокс-пары и тем больше E(OX/Red).
Например, для редокс-перехода
MnO4-+5e-+8H+ Mn2++4H2O

E(MnO4-/Mn2+) =E(MnO4Mn2+) +.
Для простоты расчетов а(Н2О) и а(Н+) обычно принимают равными единице.
Комплексообразование, как и образование малодиссоциирущего соединения, выводит закомплексованную или осажденную часть компонентов редокс-пары из участия в редокс-переходе. Из формулы Нернста следует, что комплексообразовае или осаждение ОХ-формы уменьшает величину E(OX/Red), а Red-формы вещества - увеличивает.
Например, в отсутствие комплексообразования редокс-потенциал редокс-пары Fe3+/Fe2+ рассчитывался бы по формуле
E(Fe3+/Fe2+) = E(Fe3+/Fe2+) + ![]() .
.
Комплексование формы Fe3+ в присутствии, например, ЭДТУ (см. гл.1.10) в соединение FeY - приводит к изменению активности Fe3+ до величины 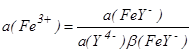 ,
,
где a(Y4-) - активность ЭДТУ; (FeY-) - константа устойчивости комплекса FeY-, т.е. константа равновесия реакции комплексообразования
Fe3++Y4 - FeY-.
После подстановки в формулу Нернста получим

E(Fe3+/Fe2+) = E(FeY-/Fe2+) +
где E(FeY-/Fe2+) =E(Fe3+/Fe2+) - 0,059lg(FeY-), и если без комплексообразования E(Fe3+/Fe2+) = 0,77 В, то при комплексообразовании с ЭДТУ E(FeY-/Fe2+) = - 0,77 В (так как (FeY-) =1025,1).
Образование малорастворимых соединений при йодометрическом определении Cu2+ (осадка CuI и ионов Cu+ и I-) приводит к тому, что в уравнении
E(Cu2+/Cu+) = E(Cu2+/Cu+) + 0,059lg![]()