Реферат: Лекции по экологии
Следует заметить, что содержание СО2 в атмосфере невелико, и он бы полностью исчерпался за 4-35 лет (табл. 2.8.).
Откуда же он поступает в атмосферу? Ежегодно все растения и животные выдыхают СО2 1013 -1014 кг, а люди – 1,08×1012 кг (пункты 3,4; рис.2.5).
Экзотермическая реакция окисления углерода до СО2 протекает в тканях живого организма под действием вдыхаемого кислорода, который переносится по кровеносной системе посредством гемоглобина – сложного органического вещества (с молярной массой М»68000 г/моль), содержащего 4 атома железа, каждый из которых способен связывать одну молекулу О2 .
Процесс дыхания упрощенно можно изобразить схематически так (где Гем – гемоглобин):
1) Гем + О2 = Гем·О2 (легкие: вдыхание);
2) Перенос с кровью в ткани;
3) Гем·О2 + С (из пищи) = Гем·СО2 (ткани);
4) Перенос в легкие;
5) Гем·СО2 = Гем + СО2 (легкие: выдыхание).
Таким образом, можно сказать, что гемоглобин ведет себя как катализатор. Другие источники поступления СО2 в атмосферу – извержения вулканов, кислотные дожди, действующие на известняки (пункт 8, рис. 2.5). Часть СО2 образуется при гниении, разложении, отмирании живых организмов под действием редуцентов, а также при пожарах и, наконец, при антропогенном воздействии. Так, ежегодно в промышленности и на транспорте при сжигании топлива выбрасывается в атмосферу 1,5×1012 кг СО2 и эта цифра ежегодно растет, что создает глобальную проблему - парниковый эффект.
Если бы не происходило побочных процессов, то количество СО2 , выделяемого в атмосферу и усваиваемого растениями, было бы одинаковым. Однако же часть углерода временно выводится из кругооборота за счет частичной минерализации останков растений (пункт 5, рис. 2.5) и животных (пункт 6, рис. 2.5) с образованием торфа, нефти, углей и других ископаемых в литосфере.
Общее количество углерода земной коры (трех оболочек), по Вернадскому, составляет примерно 1×1017 т, причем большая часть его рассеяна повсюду в природе, поэтому такой разброс в данных по распределению его по отдельным формам нахождения (табл. 2.9).
Таким образом, основная масса углерода принимает участие в медленном геологическом кругообороте. Естественно предположить, что в настоящее время атмосфера содержит лишь ничтожную часть СО2 от того запаса, который первоначально имелся, и углерод постепенно выводился из биологического кругооборота из-за отложений в литосфере. Но из-за антропогенных факторов (использование горючего, его сгорания) в последнее время доля СО2 , а значит, и углерода в атмосфере неуклонно растет из года в год.
Таблица 2.9. Количество углерода, в т
| Скопление углерода |
Количество углерода, т | |
| По Вернадскому | По Г.В. Стадницкому и А.И. Родионову | |
| Атмосфера | 3×1012 | 2,35×1012 |
| Океан | 1×1014 | - |
| Карбонатные отложения | - | 1,3×1016 |
| Кристаллические породы | - | 1×1016 |
| Известняки | 3×1016 | - |
| Живое вещество | 1×1012 | » 5×1011 |
| В растительных тканях | - | 5×1011 |
| В животных тканях | - | 5×109 |
| Каменные угли | 2×1013 | - |
| В каменных углях + нефти | - | 3,4×1015 |
Большим регулятором содержания СО2 в атмосфере является Мировой океан. Много углерода исключается из биологического кругооборота веществ на суше и попадает в океан в основном в виде карбонатных солей. Если в атмосфере повышается содержание СО2 , то часть его растворяется в воде, вступает в реакцию с СаСО3 , с образованием растворимых в воде гидрокарбонатов, например Са(НСО3 )2 . Наоборот, при уменьшении содержания СО2 в атмосфере, гидрокарбонаты, которые всегда содержатся в морской воде, превращаются в карбонаты, которые выпадают из раствора, частью используются организмами для построения скелетов или панцирей (раковин) животных, при отмирании, а частью и без отмирания в виде СаСО3 оседают на морское дно. Таким образом, существует обратимый процесс:
® уменьшение концентрации СО2
Са(НСО3 )2 « СаСО3 ¯ + Н2 О + СО2 .
¬ увеличение концентрации СО2
2.6.2. Кругооборот кислорода
Один из наиболее сложных кругооборотов, так как с кислородом О2 вступает в реакцию большое количество органических и неорганических веществ, а также водород (последний дает с О2 ® воду Н2 О). Упрощенная схема кругооборота кислорода представлена на рис. 2.8).
Кругооборот кислорода непосредственно связан с кругооборотом углерода (процессы фотосинтеза, дыхания и питания животных). Особенностью кругооборота кислорода является широкое многообразие кислородсодержащих веществ в биосфере. Кислород в
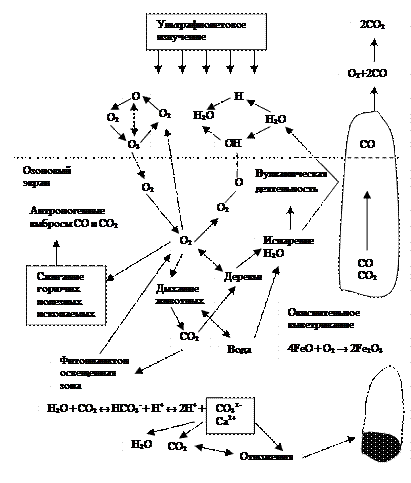
Рис. 2.8. Кругооборот кислорода
целом самый распространенный в биосфере химический элемент. В свободном виде (О2 ) он присутствует в наземных водных источниках, в почве и составляет основу воздуха, присутствуя в атмосфере также и в виде озона (главным образом в стратосфере). Роль озона в биосфере, его образование подробно рассматривается в других разделах пособия. В связанном виде кислород составляет основу горных пород и минералов (например, солевых и оксидных), а также газообразных продуктов (например, оксидов углерода, серы, азота и др.), и, наконец, воды (самого распространенного на планете вещества), образование которых рассматривается в других кругооборотах элементов и веществ.
Нарушение стабильного кругооборота кислорода происходит в основном из-за больших объемов сжигания органического топлива (свободный кислород тратиться на окисление), а с другой стороны, из-за массовой вырубки лесов (главного источника поступления свободного кислорода в биосферу). Одновременно с этим возникает целый блок глобальных проблем (парниковый эффект, кислотные дожди, явления "смога" и др.).
2.6.3. Кругооборот серы
Существуют гипотезы, что в ранние геологические эпохи Земли недостаток О2 предполагал существование серы в основном в виде Н2 S и солей (главным образом, сульфидов, например FeS2 ). С формированием О2 начинаются окислительные процессы. В наше время сера на планете присутствует в виде Н2 SО4 и Н2 S (и их солей), и части свободной серы, SО2 , а также в виде органических веществ в живых организмах.
Величайшую роль в кругообороте выполняют бактерии. Мы уже знакомы с фотосинтезом, но, кроме этого, некоторые бактерии, используя энергию химических экзотермических реакций окисления (хемосинтез), синтезируют органические вещества. Так под действием особого вида бактерий (серобактерии) идет окисление Н2 S до S:
2Н2 S + О2 ® 2Н2 О + 2S + 127 ккал (+ Q).
Cера откладывается в «телах» серобактерий, составляя до 95 % их общей массы, тем самым устраняя вредное действие Н2 S на растения и животных. Это неполный процесс окисления серы, он идет и дальше до Н2 SО4 под действием О2 воздуха, а также пурпурных бактерий, для которых дыхание заменяется процессом: