Реферат: Лекции по экологии
Н2 S + 2О2 ® Н2 SО4 + 189 ккал.
Сера окисляется на воздухе, а также в организмах серобактерий, если они будут лишены сероводородной среды:
2S + 3О2 + 2Н2 О = 2Н2 SО4 + 251 ккал,
SО2 или Н2 SО3 – практически не образуются, а образуется Н2 SО4 , так как протекают достаточно сложные процессы:
2S + 2О2 + 2Н2 О = 2Н2 SО3 + 157 ккал, (1)
2Н2 SО3 + Н2 О + O2 = 2Н2 SО4 + 94 ккал. (2)
Вторая реакция протекает быстрее, поэтому Н2 SО3 (или же SО2 + Н2 О) не накапливается. Свободная Н2 SО4 в природе встречается редко (разве что при кислотных дождях), она очень активна, поэтому реагирует с содержащимися в почве и воде веществами или горными породами, например:
СаСО3 + Н2 SО4 = СаSО4 + СО2 + 2Н2 О.
Большая часть сульфатов уносится водами рек, а также под действием осадков и выветривания минералов, в моря, частью растворяясь в океанических водах, а частью откладываясь на дне в виде напластований и образуя минералы, особенно природного гипса СаSО4 ×2Н2 О, перемещаясь в глубины литосферы, а затем через годы – на поверхность и т.д.
Попадая в глубокие слои литосферы, тот же СаSО4 , претерпевает восстановительный процесс, например, с участием органических веществ:
СаSО4 + СН4 ® СаS + СО2 + 2Н2 О ® СаСО3 + Н2 S + Н2 О.
Таким образом, возникают сероводородные («серные») источники (например, Мацеста, Пятигорск). Но существуют и другие бактерии – сульфатовосстанавливающие, которые питаются за счет сульфатов. Так, на глубине ниже 150 м, например, в Черном море, сульфаты под действием этих бактерий восстанавливаются до сероводорода, который, поднимаясь наверх, вновь подвергается действию серобактерий, окисляется до SО4 2- , а часть Н2 S уходит в атмосферу. Источники Н2 S – болота, вулканическая деятельность, природные процессы гниения отмерших живых организмов.
При извержении вулканов выделяется Н2 S и SО2 , концентрации которых могут быть различными, тогда возможно протекание реакции: 2Н2 S + SО2 ® 3S + 2Н2 О.
При избытке Н2 S, выделяющаяся сера защищается от окисления и потому может образовывать на некоторой глубине в толще литосферы – пласты S или вкрапления.
Кроме того, на больших глубинах формируются горючие природные ископаемые (тот же уголь, и углеводороды, содержащие серу), откладываются сланцы и другие осадочные породы, содержащие серу.
При добыче этих ископаемых, их сжигании или химической переработке, а также их естественном разложении в атмосферу выбрасываются SО2 и Н2 S, которые окисляются до Н2 SО4 и, наряду с природными источниками, затем выпадают на землю в виде осадков – кислотных дождей. И так, круг замыкается. Особенно из-за деятельности человека, а также из-за окислительной способности воздуха в наше время кругооборот осуществляется с увеличением содержания сульфатов, а в прошлом – преобладали сульфиды.
Остался неучтенным процесс потребления серы растениями, с учетом которого кругооборот серы можно выразить упрощенной схемой (рис. 2.9).
Переработка сульфатов растениями, в том числе и с использованием бактерий, очень сложный процесс, приводящий к синтезу растениями серосодержащих белковых веществ.
Животные, питающиеся растениями, также путем биохимических процессов синтезируют серосодержащие вещества, характерные для своих организмов. При отмирании животных и растений, их белковые вещества разлагаются до Н2 S и некоторых других серосодержащих продуктов, и кругооборот серы продолжается.
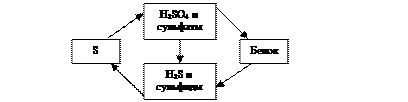
Рис. 2.9. Кругооборот серы (упрощенно)
Кругооборот серы можно представить схемой (рис. 2.10).
|
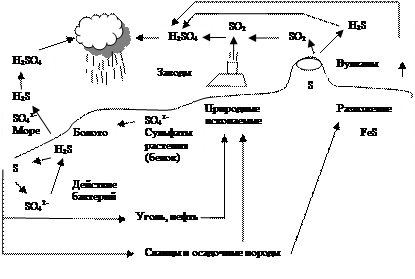
Рис. 2.10. Кругооборот серы
2.6.4. Кругооборот азота
Азот составляет примерно 78 % воздуха атмосферы. Часть его содержится в почве и в воде в виде неорганических соединений (в виде аммонийных солей, а также нитритов и нитратов), а часть – в форме органических соединений, входящих в состав растительных и животных белков, аминокислот. Существует большой кругооборот азота, включающий сушу и атмосферу, частью которого является малый кругооборот (биотический). Общая упрощенная схема кругооборота азота представлена на рис. 2.11.
|
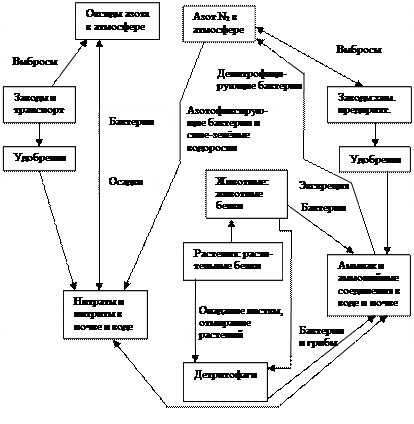
Рис. 2.11. Кругооборот азота (упрощенно)
Биогеохимический цикл азота с учетом антропогенных факторов рассмотрим подробнее. Азот в свободном виде (в виде N2 ) недоступен растениям. Для своего роста растения могут использовать лишь соли азотной и азотистой кислот, хуже – аммиачные соединения.
На границе воздушной атмосферы и грунта содержится от 0,02 до 0,056 кг/м3 азота (летом и осенью больше, чем зимой и весной, из-за грозовых разрядов). За год на 1 га в разных частях земли выпадает 2,6-14,3 кг азота. Больше всего азота вблизи больших химических предприятий, связанных с продуктами азота, поэтому в почву в радиусе нескольких километров азотных удобрений не следует вносить.
Как же азот из воздуха попадает в почву в связанном виде? Это возможно благодаря азотофиксирующим бактериям, живущим в грунтах, а также сине-зеленым водорослям в водоемах. Поэтому их значение необычайно велико. Примерами таких бактерий являются аэробные азотобактерии (действуют в присутствии кислорода воздуха), анаэробные клостридиумы Пастера (действуют без доступа О2 ), клубеньковые бактерии, живущие и функционирующие в корнях-клубнях, в основном бобовых растений. Процесс фиксации таков:
N2 + 3Н2 ® 2NН3 + 615,63 кДж.