Реферат: Лімфоцитопосередковані механізми за умов хронічної гіперімунокомплексемії та вплив на них корвітину в експерименті
Відомо, що імунокомплексне ураження тканин прямо чи опосередковано пов’язано із змінами в метаболізмі оксиду азоту (Uesugi M., 1998). Отримані експериментальні дані показали, що розвиток хронічної гіперімунокомплексемії супроводжується експресією індуцибельної NO-синтази, активність якої в лімфоцитах зросла у 4,7 раза (Р<0,001), а в клітинах ендотелію у 2 рази (Р<0,01). Потенціал конститутивної NO-синтази за цих умов зазнає інгібування – на 61,6% (Р<0,001) в лімфоцитах (рис.1) та на 36,9% (Р<0,05) у ендотеліоцитах (рис.2).
Зміна показників ферментативної активності NOS супроводжуються підвищенням метаболізму аргіназного шляху NO: активність аргінази в лімфоцитах (рис.1) зросла у 5,1 раза (Р<0,001), вміст сечовини – 3,9 раза (Р<0,001); в ендотеліоцитах (рис.2) зміни в синтезі оксиду азоту є менш значними – активність аргінази зросла в 1,6 раза (Р<0,001), вміст сечовини – 1,9 раза (Р<0,001). Можливо, підвищення рівня сечовини у клітинах, при зміні утилізації аргініну на неокисний шлях метаболізму, має компенсаторне значення, враховуючи її відому антиоксидантну роль (Коцюруба А.В., 2000; Aoyagi K., 2003).
Інгібування ферментативної активності NOS може бути зумовлено пониженням біодоступності запасів L-аргініну (Зенков Н.К., 2000; Корж А.Н., 2003), що в подальшому може призвести до порушення рівноваги між двома шляхами – окисним (NO-синтазним) і неокисним (аргіназним). Окрім цього, виявлені зміни в активності NO-синтаз, очевидно, можуть бути пов’язані із тим, що активовані імунними комплексами фагоцити індукують продукування прозапальних цитокінів, які є промоторами iNOS в імунокомпетентних клітинах (Li H., Forstermann U., 2000; Nishimura M., 2004; Nangaku M., 2005). Стійка активація прозапальних цитокінів може створювати сприятливі умови для розвитку автоімуноагресії та подальшого підтримання гіперімунокомплексемії (Чоп’як В.В. 1998; Setiady Y., 2004; Norman M., 2005).
Відомо також, що запальні цитокіни можуть діяти як тригери, що переключають синтез NO з конститутивної ізоформи на індуцибельну (Cattaruzza M. et al., 2003).
Введення корвітину інтактним тваринам показало, що його вплив на процеси синтезу оксиду азоту у лімфоцитах та ендотеліальних клітинах характеризується недостовірним підвищенням ферментативної активності NOS, сNOS та рівнів нітрит - і нітрат - аніонів. Вміст GSNO за цих умов зростає як у лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,05). Активність індуцибельної ізоформи NOS в лімфоцитах інгібована (Р<0,001), а у ендотеліоцитах зростання її показника є недостовірним. Дослідження впливу корвітину на активність аргінази і рівень сечовини у лімфоцитах та ендотеліальних клітинах інтактних тварин виявило незначне пониження їх вмісту лише у лімфоцитах (Р<0,01).
Дія корвітину на показники NO-синтазної активності за умов експериментального гіперімунокомплексного процесу мала наступні особливості: введення корвітину супроводжується зростанням сNOS в 2,6 раза у лімфоцитах (Р<0,001), де спостерігається відновлення активності цього ферменту до показників контролю та значним інгібуванням iNOS – на 60,08% (Р<0,001), проте це зменшення не було достатнім для нормалізації активності даного ферменту відносно контролю (рис.1); ферментативну активність NO-синтаз в клітинах ендотелію (рис.2) за цих умов характеризує підвищення активності сNOS, величина якої збільшилася в 2,4 раза (Р<0,001), паралельно із цим відзначено зниження активності іNOS – на 28,6% (Р>0,05). Дані величини NO-синтаз у ендотеліоцитах перевищили вихідний рівень контролю – сNOS у 1,5 раза (Р<0,05) та іNOS в 1,6 раза (Р<0,05).
Отримані експериментальні дані свідчать, що протекторні особливості водорозчинної форми кверцетину – корвітину, при даній патології пов’язані, перш за все, із його здатністю специфічно пригнічувати активність іNOS. На механізм впливу кверцетину щодо пониження активності ферменту індуцибельної NOS, як на транскрипційному, так і на посттрансляційному рівнях, шляхом інгібування експресії мРНК та пониження серії сигнальних інтрацелюлярних шляхів індуцибельної NOS вказували (Kim N.K. et al., 1999; Chen Y.C., Chakravorty M. et al., 2001).
Застосування корвітину на тлі імунокомплексної патології призвело до значних змін у показниках аргіназного шляху метаболізму NO: інгібування активності аргінази на 63,4% в лімфоцитах (Р<0,001) ), що перевищило у 1,9 раза (Р<0,001) рівень контролю, та більш суттєвого, на 83,4%, пониження вмісту сечовини (Р<0,001) (рис.1); помітно знизилась активність аргінази у ендотеліальних клітинах (рис.2), показник якої падає на 21,2%, що в 1,3 раза нижче вихідного рівня. Вміст сечовини у ендотеліоцитах за даних умов зменшився на 57,5% (Р<0,001).


Рис. 1. Показники активності синтазного і аргіназного шляхів метаболізму L-аргініну в лімфоцитах щурів за умов норми, хронічної гіперімунокомплексемії (ХГІК) та корекції корвітином.
Отже, протекторні властивості корвітину є важливим фактором впливу на синтез оксиду азоту. В умовах окисного стресу корвітин може виступати як інгібітор неокисного метаболізму L-аргініну за аргіназним шляхом, внаслідок чого нормалізується окисний метаболізм L-аргініну за NО-синтазним шляхом (Дрюк Н.Н., 2002).
Зміни у вмісті метаболітів оксиду азоту – NO2 Ї та NO3 Ї значною мірою можуть залежати від ферментативної активності NO-синтаз. Так, з підвищенням ферментативної активності iNOS за умов розвитку хронічного гіперімунокомплексного процесу понижується рівень стабільних метаболітів оксиду азоту, як у лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,001). Вміст нітрозоглутатіону за цих умов також суттєво понижений – на 89% у лімфоцитах (Р<0,001) та, на 91,2% в клітинах ендотелію (Р<0,001). Як відомо, концентрація стабільних метаболітів оксиду азоту – NO2 Ї і NO3 Ї має залежність від ступеня активності патологічного процесу (Заячківська О.С., 2006), тому зниження їх рівнів в імунокомпетентних клітинах, можливо, пов’язано з інтенсифікацією при цій патології пошкоджувальної дії активних форм кисню (Коцюруба А.В., 2000). Зменшення у лімфоцитах та ендотеліоцитах рівня нітрозоглутатіону на тлі даної патології, може бути розцінено як зниження системи антиоксидантного захисту.
Введення корвітину групі тварин із хронічною гіперімунокомплексемією супроводжується підвищенням рівня метаболітів NO2 Їі NO3 Ї, як в лімфоцитах (Р<0,001), так і в ендотеліальних клітинах (Р<0,001). Паралельно з цим відзначено зростання GSNO, особливо в ендотеліальних клітинах (Р<0,001).
Отже, виявлені ефекти корвітину можуть свідчити про те, що цей препарат гальмує надмірне утворення оксиду азоту і, таким чином, запобігає глибоким метаболічним порушенням у досліджуваних клітинах.
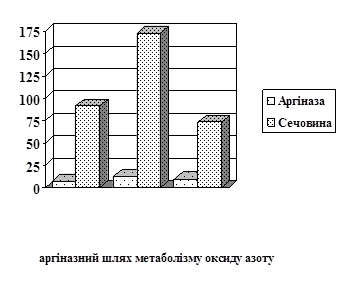
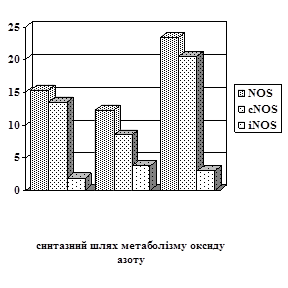
Рис. 2. Показники активності синтазного і аргіназного шляхів метаболізму L-аргініну в ендотеліоцитах щурів за умов норми, хронічної гіперімуно-комплексемії (ХГІК) та корекції корвітином.
Проведені дослідження виявили, що імунологічні та біохімічні порушення при хронічній гіперімунокомплексемії, супроводжуються морфологічними змінами в лімфоцитах та клітинах ендотелію. Електронно-мікроскопічні дослідження лімфоцитів тварин з хронічним імунокомплексним ураженням виявили виражену реакцію цих клітин на змодельований патологічний процес. Ця реакція характеризувалася переважанням деструктивних процесів: пошкодженням ультраструктури плазматичної мембрани і, навіть, її відсутністю в деяких місцях, безструктурним та неоднорідним цитоплазматичним матриксом, недиференційованими органелами, скупченням електроннощільного гранулярного матеріалу. Плазматична мембрана має множинні дефекти, а цитоплазматичній простір вільно сполучається з оточуючим інтерстицієм. Таким чином, проведені дослідження виявили, що хронічна гіперімунокомплексемія супроводжується деструктивними змінами із еле