Реферат: Механизм действия отравляющих веществ на основе фосфорорганических соединений. Способы определения и защиты
ФОС обладают способностью угнетать активность не только холинэстеразы, но и ряда других эстераз.
Более полные сведения о влиянии ФОС на эстеразу были получены в тех исследованиях, где в качестве субстрата применялись вещества различного строения.
В последние годы были получены интересные сведения о влиянии ФОС на некоторые протеолитические ферменты. Оказалось, что наряду с обычным пептидазным действием трипсин и химотрипсин обладают способностью катализировать гидролиз некоторых эфиров аминокислот, характеризующихся наличием эстеразной активности.
Таким образом, из большого числа исследованных ферментных систем только некоторые эстеразы, а так же протеазы, обладающие эстеразной активностью, оказались чувствительными к низким концентрациям ФОС.
Механизм инактивирования холинэстеразы ФОС
Для начала следует различать ацетилхолинэстеразу АХЭ и холинэстеразу ХЭ. АХЭ – специфическая или истинная холинэстераза – содержится главным образом в эритроцитах (ЭХЭ), головном мозге, окончаниях нервных волокон; холинэстераза - неспецифическая холинэстераза, псевдохолинэстераза, содержится в сыворотке крови (СХЭ).
АХЭ – фермент высокой специфичности по отношению к субстрату и гидролизует в основном ацетилхолин;
ХЭ – смесь различных эстераз.
По современным представлениям, активная поверхность холинэстеразы имеет два центра – анионный и эстератический.
Анионный центр за счёт электростатических сил притягивает к себе положительно заряженный азот ацетилхолина. Помимо этого в образующейся связи участвуют и Ван дер Ваальсовы силы, так как характер и количество алкильных радикалов на азоте играют существенную роль в прочности комплекса.
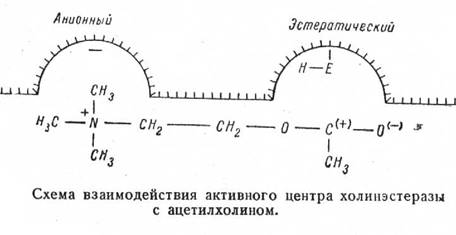
Эстератический центр в свою очередь состоит из основной (нуклеофильной) группы Е и кислотной группы, обозначенной Н.
Нуклеофильная группа обеспечивает образование комплекса фермент-субстрат, а кислотная группа необходима для осуществления реакции гидролиза.
Механизм гидролиза ацетилхолина можно представить себе следующим образом:
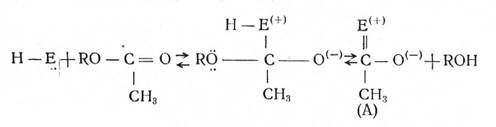
Здесь R обозначает остаток холина. На этом этапе образуется ацетилированный фермент (А) и отщепляется холин.
Ацетилированный фермент представляет собой весьма нестойкое соединение и легко разрушается под действием воды.

При этом, в конечном счёте, образуется активный фермент Н---Е и уксусная кислота.
Совершенно аналогично происходит взаимодействие холинэстеразы с ФОС.

Только в этом случае образуется не ацетилированный, а фосфорилированный фермент (Ф). В отличие от ацетилированного фермента этот комплекс остаётся прочным и, таким образом, фермент остаётся угнетённым.
Существует мнение, что разные ферменты реагируют с ФОС различными функциональными группами.
В случае чувствительных к ФОС ферментов фосфорильный остаток быстро переносится на гидроксильную группу серина, прочно закрепляется там и, таким образом, инактивирует фермент. У ферментов, гидролизирующих ФОС, в активном центре нет серинового остатка, благодаря чему фосфорсодержащая часть яда гидролитически отщепляется, а фермент восстанавливает свою активность.
При отравлениях ФОС может происходить снижение активности ХЭ, которое, однако, не находится в определённой связи с тяжестью клинических симптомов поражения. Стоит заметить, что определение активности ХЭ в сыворотке крови даёт хорошую возможность диагностировать отравления ФОС для профилактики или терапевтических целях.
Реактивирование холинэстеразы, угнетённой ФОС
Из данных, изложенных выше, вытекает, что реакция фермента с ФОС состоит в присоединении фосфорильного остатка к нуклеофильной группе эстератического центра. Можно было подумать, что если подействовать на фосфорилированный фермент более сильным нуклеофильным реагентом, то удастся вытеснить остаток ФОС из его соединения и тем самым реактивировать фермент.
Было показано, что все изученные соединения по своей активности могут быть разбиты на 4 группы:
1) Вещества, обеспечивающие более чем 50%-ное реактивирование за 1 час: диизонитрозоацетон, ПАМ, фенилглиоксим.