Реферат: Механізми інактивації потенціал-залежних К+ каналів
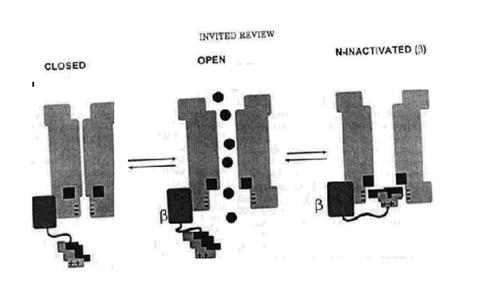
Експериментальна очевидність пітверджує ідею про те, що NH2 кінцева форма КV B1 субодиниці утворює інактиваційну частинку (В-кульку), що поводиться так само, як і ShakerBпептид. КV B1 NH2 кінець має подібну первинну структуру з NH2 кінцем інактиваційних К+ каналів ссавців (і родиною Shakerдрозофіли). Ця подібність включає кластер гідрофобних амінокислот та групу заряджених залишків. Делеція КV B1 NH2 кінця унеможливлює швидку інактивацію при коекспресії з RCK1, а додавання відповідного пептиду всередину клітини, відновлює її.
Як і у випадку з ShakerB пептидом, інактивація за допомогою b-кульки зростає при збільшенні позитивного заряду кульки. Більше того, коекспресія KV b1 з ShBD6–46 веде до виникнення інактиваційних К+ струмів. Виявляється, що b-кулька може повністю повторювати функції раніше описаної NH2 – кінцевої ділянки a субодиниці. (мал.2, мал.3) Природньо припустити, що обидві “кульки” взаємодіють з одним тим самим сайтом на внутрішньому гирлі каналу, оскільки обидві мають гідрофобний профіль і b- інактивація дестабілізується підвищенням концентрації К+ назовні клітини, що відбувається при класичному N-типові інактивації.
 |
Можливість комбінування різних ізоформ a чи b- субодиниць в К+ каналах розглядається як спосіб фізіологічної модуляції інактивації К+ каналів invivo.
С- тип інактивації.
Ми вже розглянули N-тип інактивації, яка відбувається швидко, однак, виявляється, що багато К+ каналів демонструють іншу форму інктивації – повільну.
Робота Hoshietal. показала, що саме СООН- кінцевий домен бере участь в цьому типові інактивації (інактивації за С-типом). Ця ідея виникла після спостереження того, що альтернативно сплайсовані С-кінцеві варіанти показували різний рівень повільної інактивації. Iverson & Ruby також помітили, що різні С – кінці впливають на стабільність довготривалого інактивованого стану в різних конструктах Shaker . Інші дослідження показали, що С- інактивація відбувається принципово іншим чином, ніж N- інактивація.
Внутрішньоклітинний ТЕА, що конкурує за зв’язування рецептора на внутрішньому гирлі каналу з кульковим пептидом, не впливає на повільну інактивацію. Але зовнішній ТЕА сповільнює С- інактивацію та зменшує макроскопічний струм у ShBD6–46 мутантів. Рівні інактивації мають лінійну залежність від концентрації ТЕА іззовні, і амплітуди струму також пропорційно зменшуються. Цей вплив ТЕА на С- тип інактивації відповідає моделі “нога в дверях”. Оскільки трипсин не виявив ніякого впливу на зовнішній бік каналу при С- інактивації, механізм “кульки й ланцюжка” було виключено. Тоді дослідники висловили припущення, що при С-типові інактивації відбуваються більш значні структурні перебудови з зовнішнього боку мембрани. Хоча деякі експерименти з реєстрацією струмів у дикого типа ShBD6–46 і підтвердили справедливість моделі “footinthedoor”, однак інші дослідження показали, що ефекти проникливих йонів на С-тип інактивації не можна розглядати за такою спрощеною схемою.
Наприклад, Lopez-Barneoetal. зробили низку амінокислотних замін в Shaker В каналах, які не мали N- типу інактивації і виявилося, що найдраматичніші наслідки для інактивації за С- типом мала заміна в Т449К мутанта, коли рівень інактивації зменшувався в 42 рази порівняно з нормальними каналами. Таким чином, амінокислотний залишок в 449 положенні виявляється критичним для визначення рівня інактивації. З іншого боку Lopez-Barneo помітив, що зовнішні катіони на додаток до того, що вони сповільнюють С-тип інактивації, можуть також впливати на кількість каналів, які відкриваються при деполяризації. Цей ефект більше проявлявся у тих мутантів, які характеризувалися більш швидкою С- інактивацією, а саме у Т449А, Т449Е, Т449К. В цих трьох випадках величина пікового струму на стільки залежала від зовнішньої концентрації К+ , що струм зовсім не виникав за відсутності К+ . Pardo та співробітники помітили, що калієвих струмів, індукованих KV 1.4 в ооцитах Xenopus зовсім не виникало при заміні зовнішнього К+ на непроникні катіони. Цей ефект опосередкований зниженням кількості каналів, здатних до відкривання.
Подальші тонкощі механізму С-інактивації досліджував Yellen з колегами. Їм вдалося встановити, що С-тип інактивації включає в себе конформаційні зміни в зовнішньому гирлі каналу. Вони показали, що перехід від відкритого до С-інактивованого стану змінює афінність каналу до Cd2+ у 45.000 разів. А саме присутність йонів Cd2+ прискорює перехід каналу до С-інактивованого стану. Yellen запропонував таке пояснення своїх спостережень. Чотири цистеїнові залишки в 449 положенні у відкритому каналі, ймовірно, розташовані далеко один від одного, зважаючи на низьку афінність до зв’язування Cd2+ . Інактивація зводить їх докупи, утворюючи високоафінний центр зв’язування Cd2+ , який стабілізує інактивований стан.
Підсумовуючи обговорення даних по С-інактивації з певністю можна сказати, що це дуже складний процес, який відбувається не лише за допомогою СООН- кінця калієвих каналів, але проходить зі структурними перебудовами канальної структури, або близьких до неї доменів. Графічно процес, який відбувається, можна зобразити як спадання стінок каналу, через який протікає струм за участю катіонів, які впливають на зовнішню частину каналу.
Підсумок.
Та інформація, якою ми володіємо насьогодні дозволяє нам розуміти швидку інактивацію як наслідок міжмолекулярної взаємодії цитоплазматичного N-кінцевого домена з рецептором, розташованим у внутрішньому гирлі каналу. N-кінець сполучається з рештою канальної структури за допомогою ланцюжка. Інактивація за цим типом відбувається внаслідок електростатичної взаємодії між основними залишками кулькового пептиду і кислотними залишками в гирлі каналу лише тоді, коли канал перебуває у відкритому стані. Вихід каналу з інактивації відбувається внаслідок спонтанного вивільнення кулькового пептиду з рецептора.
Відомості про С-тип інактивації досі ще не дуже певні, але більшість даних свідчить про обов’язкові конформаційні зміни із зовнішнього боку канальної структури в процесі такої інактивації.
Використана література.
1. Kukuljan Manuel, Pedro Labarca and Ramon Latorre. Molecular determinants of ion conduction and inactivation in K+ channels. /Am.J.Physiol.268. C535-556,1995.
2. Sanguinetti M.C. and Jurkiewicz N.K. Delayed Rectifier Potassium Channels of Cardiac Muscle /Am.J.Physiol.. C120-142,1995.
3. Karen K.Deal, Sarah K. England. Molecular Physiology of Cardiac Potassium Channels/Physiological reviews,vol 76#1,C49-76,1996.