Реферат: Методы экстракции в исследовании равновесий
Предложены способы экстракции большинства элементов и многих классов соединений. В качестве факторов, влияющих на процесс извлечения, широко используют комплексообразование и регулирование рН.
Варьирование условий экстракции открывает широкие возможности для аналитического применения ее с целью разделения и отделения различных ионов друг от друга. Здесь указано несколько примеров влияния условий экстракции на ее результат:
а) алюминий может быть отделен от железа и титана экстракцией хлороформом оксихинолятных комплексов этих металлов (при рН = 5 в хлороформный слой экстрагируется только оксихинолят алюминия);
б) никель и кобальт могут быть отделены от всех других металлов экстракцией хлороформом их комплексов с α-бензоил-диоксимом в широком интервале рН;
в) медь от многих металлов может быть отделена экстракцией гексанолом при рН = 7 в виде комплекса с батокупроионом;
г) титан от железа и алюминия можно отделить экстракцией хлороформом при рН = 5,3 его комплекса с 8-оксихинальдином, от ниобия и -тантала - титан можно отделить экстракцией изоамиловым спиртом из раствора, содержащего тартрат аммония, купферонатного комплекса титана при рН = 5.
Распределение вещества между двумя несмешивающимися жидкостями можно использовать для исследования равновесий комплексообразования. Распределяющимся веществом может быть лнганд или металлсодержащее соединение. Требование, чтобы две жидкие фазы, одной из которых обычно бывает вода или водный раствор, не смешивались, нередко выполняется частично. Если взаимная растворимость двух жидкостей значительна, то необходимо учитывать изменение среды и влияние этого изменения на константы комплексообразования. При изучении равновесий комплексообразования в водных растворах в качестве второй жидкости используют органический растворитель. Экстракцию соединений можно контролировать рядом методов. Наиболее общим является использование радиоактивных изотопов. Этот метод позволяет работать с очень низкими концентрациями металлов, что позволяет изучать моноядерные комплексы таких металлов, для которых характерно образование полиядерных комплексов.
Экспериментальная техника экстракции очень проста. Очень важно, чтобы обе жидкости были взаимно насыщены до экстракции. Для оценки константы равновесия распределение вещества должно быть определено в зависимости от изменения концентрации компонентов реакции экстракции. Каждое значение этой функции, т. е. каждая точка кривой распределения, определяется отдельным экспериментом. Недавно Рейнгард и Ридберг создали «прибор для непрерывного измерения экстракционных коэффициентов распределения». Этот прибор в настоящее время коммерчески доступен под наименованием AKUFVE — название прибора — начальные буквы слов, составляющих приведенную выше фразу в кавычках на шведском языке.
Прибор является одним из тех, который обладает исключительно большими возможностями для изучения равновесий комплексообразования, можно сказать, что создание автоматической аппаратуры для исследования экстракции представляет собой очень важное достижение.
Число работ по различным аспектам применения экстракции в химии растворов огромно, но здесь можно напомнить только о некоторых классических и наиболее важных.
1. Распределение лиганда
Если экстрагируется нейтральный лиганд или сопряженная ему кислота, в то время как комплекс металла не экстрагируется, то об образовании комплекса можно судить по изменению распределения лиганда в зависимости от концентрации иона металла (или лиганда).
Доусон и Мак-Грей уже в 1900 г. изучили образование аммиачных комплексов меди(II), исследуя распределение аммиака между водным раствором и органическими растворителями. Позднее этот же метод был использован для исследования комплексов гидразина, пиридина, анилина, ненасыщенных углеводородови комплексов (С2 Н5 0)2 РООН.
2. Распределение комплексов металлов
Экстрагируемость ионов металлов и комплексов металлов различными растворителями определяется многими условиями. Если лиганд заряжен и в процессе последовательного комплексообразования образуется электронейтральный комплекс, то этот комплекс может извлекаться органическим растворителем с низкой диэлектрической постоянной. Иногда этот незаряженный комплекс является последним в серии последовательно образующихся комплексов, но отмечены случаи, когда имеет место даль-
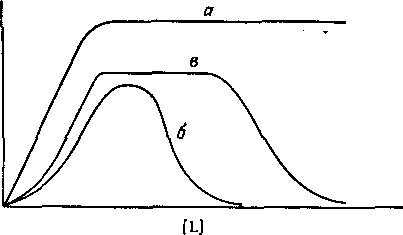
Рис. 1. Зависимость коэффициента распределения q экстрагируемого соединения от концентрации свободного лиганда.
а — образуется координационно насыщенный электроне игральны и комплекс;
6 -- а системе образуется анионный комплекс; в — образуется очень устойчивый электроне игральный комплекс с последующим образованием анионного комплекса.
нейшее присоединение лигандов с последующим образованием комплексных анионов.
В большинстве случаев анионные комплексы не экстрагируются, так что вид кривой распределения комплекса от концентрации лиганда будет разным в зависимости от того, образуется ли в системе анионный комплекс или нет. Коэффициент распределения представляет собой отношение общей концентрации металлсодержащих частиц в обеих фазах:
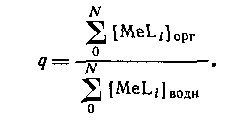
Если MeLm является единственным комплексом, присутствующим в значительных количествах в органической фазе, то
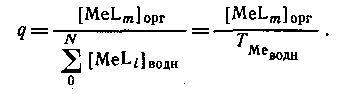
Следовательно, если m = N , то q([L]) представляет собой монотонную функцию, в то время как при N>m эта функция имеет максимум. Если устойчивость нейтрального комплекса достаточно велика, то функция q от [L] имеет отчетливо выраженное плато. Учитывая, что константа распределения соединения MeLm определяется уравнением

концентрацию MeLm в водной фазе можно определить, вводя константу устойчивости:
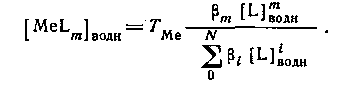
Следовательно,