Реферат: Модели атома и теория Бора
Введение. 3
Теория атома Н. Бора. Принцип соответствия.5
Идеи и понятия квантовой механики. Принцип неопределенности.8
Проблема интерпретации квантовой механики. Принцип дополнительности.11
Список литературы.. 15
Введение
Истоки квантовой физики можно найти в исследованиях процессов излучения тел. Еще в 1809 г. П. Прево сделал вывод, что каждое тело излучает независимо от окружающей среды. Благодаря развитию спектроскопии в XIX в. при изучении спектров излучения начинают обращать внимание и на спектры поглощения. При этом выясняется, что между излучением и поглощением тела существует простая связь: в спектрах поглощения отсутствуют или ослабляются те участки спектра, которые испускаются данным телом. Этот закон получил объяснение только в квантовой теории.
Г. Кирхгоф в 1860 г. сформулировал новый закон, который гласит, что для излучения одной и той же длины волны при одной и той же температуре отношение испускательной и погло-щательной способностей для всех тел одинаково. Другими словами, если Ехт и Ахт - соответственно испускательная и поглоща-тельная способности тела, зависящие от длины волны к и температуры Т, то
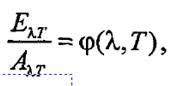
где ![]() - некоторая универсальная функция, одинаковая для всех тел.
- некоторая универсальная функция, одинаковая для всех тел.
Кирхгоф ввел понятие абсолютно черного тела как тела, поглощающего все падающие на него лучи. Для такого тела, очевидно, Ахт = 1; тогда универсальная функция ф( А., 7) равна испускательной способности абсолютно черного тела. Сам Кирхгоф не определил вид функции ![]() , а лишь отметил некоторые ее свойства.
, а лишь отметил некоторые ее свойства.
При определении вида универсальной функции ![]() естественно было предположить, что можно воспользоваться теоретическими соображениями, прежде всего основными законами термодинамики. Л. Больцман показал, что полная энергия излучения абсолютно черного тела пропорциональна четвертой степени его температуры. Однако задача конкретного определения вида функции Кирхгофа оказалась весьма трудной, и исследования в этом направлении, основанные на термодинамике и оптике, не привели к успеху.
естественно было предположить, что можно воспользоваться теоретическими соображениями, прежде всего основными законами термодинамики. Л. Больцман показал, что полная энергия излучения абсолютно черного тела пропорциональна четвертой степени его температуры. Однако задача конкретного определения вида функции Кирхгофа оказалась весьма трудной, и исследования в этом направлении, основанные на термодинамике и оптике, не привели к успеху.
Опыт давал картину, не объяснимую с точки зрения классических представлений: при термодинамическом равновесии между колеблющимися атомами вещества и электромагнитным излучением почти вся энергия сосредоточена в колеблющихся атомах и лишь ничтожная часть ее приходится на долю излучения, тогда как согласно классической теории практически вся энергия должна была бы перейти к электромагнитному полю.
В 1880-е гг. эмпирические исследования закономерностей распределения спектральных линий и изучение функции (р(Х,7) стали более интенсивными и систематическими. Была усовершенствована экспериментальная аппаратура. Для энергии излучения абсолютно черного тела В. Вин в 1896 г., Дж. Рэлей и Дж. Джине в 1900 г. предложили две различные формулы. Как показали экспериментальные результаты, формула Вина асимптотически верна в области коротких волн и дает резкие расхождения с опытом в области длинных волн, а формула Рэлея - Джинса асимптотически верна для длинных волн, но не применима для коротких.
I В 1900 г. на заседании Берлинского физического общества М. П л а н к предложил новую формулу для распределения энергии в спектре черного тела. Эта формула полностью соответствовала опыту, но ее физический смысл был не вполне понятен. Дополнительный анализ показал, что она имеет смысл только в том случае, если допустить, что излучение энергии происходит не непрерывно, а определенными порциями - квантами (е). Более того, е не является любой величиной, а именно, е = hv , где А - определенная константа (постоянная Планка), av — частота света. Это вело к признанию наравне с атомизмом вещества атомизма энергии или действия, дискретного, квантового характера излучения, что не укладывалось в рамки представлений классической физики.
Формулировка гипотезы квантов энергии была началом новой эры в развитии теоретической физики. С большим успехом эту гипотезу начали применять для объяснения других явлений, которые не поддавались описанию на основе представлений классической физики.
Существенно новым шагом в развитии квантовой гипотезы было введение понятия квантов света. Эта идея была разработана в 1905 г. Эйнштейном и использована им для объяснения фотоэффекта. В целом ряде исследований были получены подтверждения истинности этой идеи. В 1909 г. Эйнштейн, продолжая исследования законов излучения, показывает, что свет обладает одновременно и волновыми, и корпускулярными свойствами. Становилось все более очевидно, что корпускулярно-волновой дуализм светового излучения нельзя объяснить с позиций классической физики. Требовались новые понятия, новые представления и новый научный язык, для того чтобы физики могли осмыслить эти необычные явления. Все это появилось позже — вместе с созданием квантовой механики.
Теория атома Н. Бора. Принцип соответствия.
В свете тех выдающихся открытий конца XIX в., которые революционизировали физику, одной из ключевых стала проблема строения атомов. Еще в 1889 г. в своей Фарадеевской лекции Д.И. Менделеев отмечал, что в результате выявления специфической периодичности химических свойств элементов, расположенных по возрастающим атомным весам, центральной проблемой физики становится проблема строения атома1 .
В 1909—1910гг. Э. Резерфордом были проведены экспериментальные исследования рассеяния а-частиц тонким слоем вещества. Как показали эти исследования, большинство а-частиц, пронизывающих тонкий слой вещества, рассеиваются силовыми центрами, которые действуют на них с силой, обратно пропорциональной квадрату расстояния. Некоторые сравнительно немногие частицы отклонялись на угол 90° и более; по-видимому, они встретились с очень сильными электрическими полями. Результаты этого исследования позволили Резерфорду в 1911 г. сформулировать планетарную модель атома. По модели Резерфорда, атом состоит из положительного ядра гораздо меньших размеров, нежели атом, — порядка Ю-13 см. Вокруг ядра вращаются электроны. Общий заряд атома равен нулю, поэтому заряд ядра по абсолютной величине равен пе, где п — число электронов в атоме, е — заряд электрона. Резерфорд полагал также, что число электронов в атоме должно быть равно порядковому номеру элемента в периодической системе Менделеева. Но модель Резерфорда не объясняла многие выявленные к тому времени закономерности излучения атомов, вид атомных спектров и др.
Более совершенную квантовую модель атома предложил в 1913 г. молодой датский физик Н. Бор, работавший в лаборатории Резерфорда. Бор понял, что для построения теории, которая объясняла бы и результаты опытов по рассеянию а-частиц, и устойчивость атома, и сериальные закономерности, и ряд других экспериментальных данных, нужно отказаться от ряда принципов классической физики. Бор взял за основу модель атома Резерфорда и дополнил ее новыми гипотезами, которые не следуют или даже противоречат классическим представлениям. Эти гипотезы известны как постулаты Бора. Они сводятся к следующему.
1. Каждый электрон в атоме может совершать устойчивое орбитальное движение по определенной орбите, с определенным значением энергии, не испуская и не поглощая электромагнитного излучения. В этих состояниях атомные системы обладают энергиями, образующими дискретный ряд: Ех , Е2 ,..., Е". Состояния эти характеризуются своей устойчивостью. Всякое изменение энергии в результате поглощения или испускания электромагнитного излучения может происходить только скачком из одного состояния в другое.
2. Электрон способен переходить с одной стационарной орбиты на другую. Только в этом случае он испускает или поглощает определенную порцию энергии монохроматического излучения определенной частоты. Эта частота зависит от уровня изменения энергии атома при таком переходе. Если при переходе электрона с орбиты на орбиту энергия атома изменяется от Ет до Еп , то испускаемая или поглощаемая частота определяется условием hv =Е -Е.
Эти постулаты Бор использовал для расчета простейшего атома (водорода), рассматривая первоначально наиболее простую его модель: неподвижное ядро, вокруг которого по круговой орбите вращается электрон. Объяснение спектральных линий водорода было большим успехом теории Бора.
Квантовые постулаты Бора были лишь первым шагом в создании квантовой теории атома. Поэтому пришлось воспользоваться следующим приемом: сначала задача решалась при помощи классической механики (заведомо неприменимой полностью к внутриатомным движениям), а затем из всего непрерывного множества состояний движения, к которым приводит классическая механика, на основе квантовых постулатов отбирались квантовые состояния. Несмотря на все несовершенство этого метода, он привел к большим успехам — позволил объяснить сложные закономерности в атомных и молекулярных спектрах, осмыслить природу химических взаимодействий и др. Такой подход, по сути, является частным случаем общего принципа, играющего важную роль в современной теоретической физике — принципа соответствия, который гласит, что всякая неклассическая теория в соответствующем предельном случае переходит в классическую.
Важным достижением Бора и других исследователей было развитие представления о строении многоэлектронных атомов. Предпринятые шаги в развитии теории строения более сложных (чем водород) атомов и объяснении структуры их спектров принесли некоторые успехи. Однако они не означали, что эту теорию можно считать завершенной. Во-первых, постулаты Бора и многие принципы его теории имели характер непонятных, ни откуда не следуемых утверждений, которые еще должны получить свое обоснование. Во-вторых, в некоторых даже довольно простых случаях применение данной теории встречало непреодолимые трудности; например, попытки теоретически рассчитать даже такой, казалось бы, простой атом, как атом гелия, не привели к успеху. Физики ясно понимали неудовлетворительность боровской теории атома)
Таким образом, в первой четверти XX в. перед физикой все еще стояла задача углубления теории атомных явлений. Ее решение потребовало выработки еще более радикальных теоретических принципов. К таковым прежде всего следует отнести гипотезу французского физика Луи де Бройля(1924) о том, что корпускулярно-волновой дуализм носит всеобщий характер, волновые свойства присущи любым частицам материи, т.е. не только фотону, но и электрону, протону и др. Согласно де Бройлю, любой частице материи можно поставить в соответствие волну, длина которой Х2 связана с импульсом частицы р следующим соотношением: Я.2 = h / p . Уже в 1927 г. справедливость гипотезы де Бройля была подтверждена экспериментами К.Дж. Дэвиссона и Л. Джер-мера по дифракции электронов, в результате которых выяснилось, что правильно и количественное соотношение для длин «волн де Бройля».
Кроме того, дальнейшая разработка боровской теории атома приводила к выводу о необходимости еще более радикального отказа от понятий и представлений классической механики (невозможно описание движения электронов в атоме в классических образах траектории, орбиты и др.) и создания такой теории, которая оперировала бы величинами, относящимися к начальному и конечному состояниям атома. Такая теория была создана в 1925— 1927 гг. целой плеядой, интернациональным коллективом физиков-теоретиков XX в. Среди них такие выдающиеся физики, яркие «звезды первой величины», как Н. Бор, В. Гейзенберг, Э. Шрёдин-гер, Л. де Бройль, М. Борн, П. Иордан, В. Паули, П. Дирак и др.
Идеи и понятия квантовой механики. Принцип неопределенности.
В 1925 г. В.Гейзенберг построил так называемую матричную механику; а в 1926 г. Э. Шрёдингер разработал волновую механику. Вскоре выяснилось, что и матричная механика, и волновая механика — различные формы единой теории, получившей название квантовой (нерелятивистской) механики.
--> ЧИТАТЬ ПОЛНОСТЬЮ <--