Реферат: Молекулярные механизмы сплайсинга
На рис. 2 представлена схема экзонной структуры гена модулятора cAMP-респонсивного элемента человека (CREM) . Во время сперматогенеза происходит переключение с синтеза репрессоров транскрипции CREMальфа , CREMбета и CREMгамма на образование CREMтау , который содержит две дополнительные последовательности, обогащенные Gln (Q1 и Q2), необходимые для транс-активации транскрипции. Более короткий транскрипт, синтез которого инициируется на промоторе P2, процессируется с образованием зрелых мРНК, которые кодируют группу небольших молекул репрессоров (ICER). Инициация синтеза РНК на промоторе P2 активируется под действием ритмических гормональных сигналов эпифиза мозга.
В результате использования такого механизма одна и та же последовательность нуклеотидов гена может кодировать несколько разных белков. Комбинаторика объединения последовательностей нуклеотидов пре-мРНК в процессе альтернативного сплайсинга может быть очень сложной, поскольку в него вовлекаются интроны и экзоны, а их объединение происходит с использованием различных точек сплайсинга, локализованных в этих последовательностях. Распознавание участков ДНК, в которых находятся точки сплайсинга, участвующие в конкретном акте посттранскрипционного процессинга пре-мРНК, происходит с участием специфических белков в результате белково-нуклеинового взаимодействия.
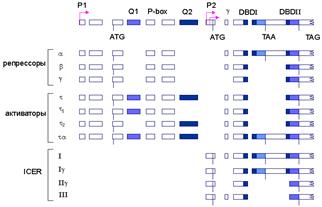
Рис. 2. Схема формирования активаторов и репрессоров транскрипции, кодируемых геном CREM и образующихся в результате альтернативного сплайсинга.
В верхней части рисунка изображена схема гена CREM, включающая альтернативные промоторы Р1 и P2, кодоны альтернативной инициации и терминации трансляции, а также экзоны, кодирующие различные домены факторов. Внизу представлены комбинации последовательностей экзонов, объединяющихся в зрелые мРНК, которые кодируют разных представителей групп репрессоров и активаторов транскрипции, а также ICER-белков.
Сборка сплайсосомы
Каноническая модель формирования активной области сплайсосомы представляет собой упорядоченный пошаговый процесс соеднения единиц мяРНП на подложке пре-мРНК. Во время первичного распознавания пре-мРНК происходит связывание мяРНП U1 с 5'-стыком пре-мРНК, а также формирование из других белковых факторов фиксационного комплекса или раннего комплекса (Е-комплекса) для млекопитающих. Фиксационный комплекс — АТФ-независимое образование, удерживающее пре-мРНК для осуществления сплайсинга.
Малый ядерный рибонуклеопротеин U2 связывается с областью ветвления за счет взаимодействия с компонентом Е-комплекса U2АF (вспомогательным фактором мяРНП U2) и, возможно, с U1. В результате АТФ-зависимой реакции U2 образует прочную связь с последовательностью точки ветвления (ПТВ), тем самым формируя комплекс А. Двойная связь между U2 и областью ветвления пре-мРНК вытягивает аденозин из ответвляющейся цепочки. Присутствие же в U2 псевдоуридиновых остатков практически напротив области ветвления приводит к изменению конфигурации связей РНК-РНК во время связывания с U2. Эти изменения структуры, вызванные псевдоуридином, помещает 2'-OH-группу вытянутого аденозина в положение, позволяющее совершить первый шаг сплайсинга.
U4, U5 и U6, соединяющиеся с образованием более крупного тройственного мяРНП, связываются с собираемой сплайсосомой и формируют комплекс В, который после некотороых промежуточных перегруппировок субъединиц превращается в комплекс С — собственно сплайсосому, которая приступает к катализу сплайсинга.
Неясно, каким образом тройственный мяРНП U4-U5-U6 связывается с комплексом А. Этот процесс может опосредоваться взаимодействием между белками, равно как и взаимодействиями между нуклеотидами мяРНК, входящих в состав U2 и U6.
U5 взаимодействует с последовательностями на 5'- и 3'-концах сплайсингового участка за счет инвариантной петли мяРНК, входящей в его состав. Белковые компоненты U5 взаимодействуют с 3'-регионом сплайсингового участка.
После связывания с тройственным мяРНП и перед началом сплайсинга в сплайсосоме происходит множество изменений конфигурации связей РНК-РНК. Эти изменения продолжаются и в уже начавшей работу сплайсосоме. Многие взаимодействия между РНК являются взаимоисключающими, однако до сих пор неясно, что вызывает эти взаимодействия и благодаря чему соблюдается их порядок.
Первое преобразование — это, возможно, смещение U1 с 5’-конца сплайсингового участка и возникновение там связи с U6. Известно, что U1 слабо связан с действующей сплайсосомой, а также является ингибитором для образования связи между U6 и 5'-концом (показано на примере короткой цепочки РНК, содержащей 5'-экзон и 5'-конец сплайсингового участка).
Связывание U2 с ПТВ — еще один пример взаимодействия между РНК, возникающего на месте взаимодействия между РНК и белками. При связывании U2 со сплайсосомой, белок Е-комплекса SF1, связывающийся с участком ветвления, вытесняется, так как наличие U2 исключает его связывание с этим участком. Внутри самого U2 также происходят некоторые взаимоисключающие переконфигурации. Например, в его активной форме, возникает шпилька IIа, а неактивной же форме доминирует взаимодействие между шпилькой и последующим участком цепи.
Неясно, за счет чего U4 отделяется от U6. Считается, что в сборке сплайсосомы участвует несколько хеликаз, которые могут раскручивать РНК в связке U4-U6 и таким образом упрощать формирование связи U2-U6.
Связи между шпильками I и II в мяРНП U4 и U6 разрываются, и освободившийся участок шпильки II U6 сворачивается сам на себя с образованием внутримолекулярной шпильки. После этого потребность в U4 отпадает. Освободившийся участок шпильки I U6 связывается с мяРНК U2 с образованием U2-U6-спирали I. Структура спирали I, однако, взаимоисключающа с 3'-половиной участка внутренней 5’-шпильки мяРНК U2.

Рис. 3. Схема расположения кодирующих белок (экзоны, синий цвет) и некодирующих белок (интроны (серый) цвет 3' и 5' нетранслируемые области (зелёный) в гене человека CDK4
СПЛАЙСИНГ БЕЛКОВ
Введение
В настоящее время кардинально меняются многие взгляды на основы жизни. Молекулярная биология — не исключение. Например, еще лет 10–15 назад термин «катализ» связывали исключительно с белками, а «сплайсинг» — с нуклеиновыми кислотами (в основном РНК). Однако постепенно стало понятно, что каждый класс макромолекул обладает намного большей функциональностью. Например, в 1982–1983 гг. было показано, что некоторые разновидности РНК, подобно белкам, обладают каталитической активностью (они получили название рибозимов). В последние годы было открыто, что некоторые малые РНК способны регулировать и даже блокировать экспрессию генов. А в 1990 г. было обнаружено явление белкового автосплайсинга — процесса, аналогичного сплайсингу РНК. С этого момента стало ясно, что канонические законы молекулярной биологии, недавно еще казавшиеся абсолютными и незыблемыми, отражают только наиболее общие принципы живого, и должны дополняться, исправляться, а иногда и заново переписываться.
Splice (англ. «сшивать, соединять») — соединение двух отрезков верёвки или каната путём сплетения их концов (морской термин).
Сплайсинг — это процесс дозревания молекул, в результате которого из предшественника удаляется внутренняя часть с последующим лигированием (т. е. образованием ковалентной связи) фланкирующих последовательностей (т. е. тех частей молекулы, что примыкали к концам удалённой внутренней части).
Сплайсинг белков, или белковый сплайсинг - это внутримолекулярный автокаталитический процесс, происходящий в некоторых белках, при котором внутренняя часть белка (под названием интеин) выщепляется из белка-предшественника с последующим лигированием оставшихся частей. На месте сплайсинга в белке-предшественнике находится цистеин или серин, то есть аминокислота с нуклеофильной боковой группой. Известные в настоящее время реакции сплайсинга не требуют экзогенных кофакторов и источников энергии (например, АТФ или ГТФ). Словом «сплайсинг» обозначают обычно сплайсинг пре-мРНК.
Сплайсинг белков был открыт двумя группами исследователей (Анраку и Стивенса) в 1990 г. Обе группы открыли белок VMA1 дрожжей Saccharomyces cerevisiae, предшественник вакуолярной H+ -АТФазы. Аминокислотная последовательность N- и С-концов VMA1 на 70% соответствует последовательности вакуолярной H+ -АТФазы других организмов, тогда как центральная последовательность на 30% совпадает с дрожжевой нуклеазой НО.
Белковый сплайсинг был открыт при исследовании дрожжевого гена VMA1, кодирующего субъединицу Vma1 вакуолярной ATФазы. Оказалось, что в результате дозревания центральная часть белка удаляется, а фланкирующие ее последовательности лигируются («сшиваются» между собой). При этом для концевых последовательностей дрожжевого гена VMA1 характерна высокая степень гомологии с аналогичными последовательностями других микроорганизмов, тогда как в центральной части она нарушалась. Так стало ясно, что и у белков в некоторых случаях может происходить процесс, аналогичный сплайсингу пре-мРНК. Также как и в автосплайсинге РНК, для сплайсинга белков не требуются ни ферменты, ни кофакторы. По аналогии центральную часть белка (которая самовырезается) назвали интеином (от internal protein), фланкирующие последовательности — N- и С-экстеинами- и С-экстеинами (external protein), а весь процесс — белковым сплайсингом (рис. 1).

Рис. 1. Схематическое строение основных типов интеинов.
А. Классический интеин, содержащий эндонуклеазный домен, Б. Мини-интеин. Консервативные аминокислотные остатки, необходимые для сплайсинга, обозначены однобуквенными аббревиатурами (один остаток с N-конца интеина и триада остатков — на стыке с C-конца и C-экстеина).
Структура интеинов
Условно интеины можно поделить на две большие группы — классические интеины и мини-интеины. Классический интеин состоит из двух доменов — сплайсингового домена, который как раз и катализирует вырезание интеина из белка-хозяина и последующее его сшивание (так сказать, «заметает следы»), и центрального эндонуклеазного домена (который может разрезать ДНК по определенным сайтам), обеспечивающего так называемый «хоуминг» интеина. Хоуминг — настолько интересный процесс, что подробнее мы его рассмотрим ниже. В двух словах скажем только, что он (хоуминг) отвечает за распространение гена интеина (что даже больше похоже на размножение, если б этот термин можно было применить к отдельному белку). Мини-интеины не имеют центрального эндонуклеазного домена и хоумингом не занимаются.
Эндонуклеазный и сплайсинговый регионы образуют в молекуле интеина два пространственно разделенных домена. Сплайсинговый домен образуется N- и С-концевыми частями интеина. Он имеет характерную подковообразную форму. Концы интеина жёстко зафиксированы друг напротив друга в пространстве, и по сути формируют активный центр (АЦ), очень похожий на АЦ трипсина или любой другой сериновой протеазы. Оба конца интеина, по которым происходит разрезание, находятся около АЦ (рис. 2).
