Реферат: Неспецифический иммунитет
Нейтрофилы и макрофаги представляют собой фагоциты, которые путешествуют по организму в поисках проникших сквозь первичные барьеры чужеродных микроорганизмов. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50% -60% общего количества циркулирующих лейкоцитов. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1. Кроме того, макрофаги выполняют роль уборщиков, избавляя организм от изношенных клеток и другого мусора, а также роль антиген-презентирующих клеток, активирующих звенья приобретённого иммунитета. [4]
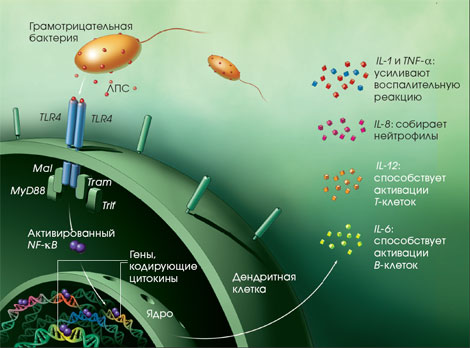
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, то есть, расположены они, главным образом, в коже, носу, лёгких, желудке и кишечнике. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врождённым и приобретённым иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретённого иммунитета.
Бактерицидная активность фагоцитов
Еще в 1908 г. русский ученый И.И. Мечников открыл не только прямые бактерицидные свойства микрофагов-нейтрофилов и макрофагов, но и также предполагал другие возможные их функции, как, например, передача иммунитета…посредствам белых корпускул через продукцию "секретинов". Нейтрофилы являются короткоживущими, но чрезвычайно многочисленными, и им была отведена фундаментальная роль в разрушении внеклеточных патогенов и их токсинов, тогда как другая группа фагоцитов, производных от моноцитов-макрофаги, относятся к длительноживущим клеткам. В дополнение к бактерицидной активности фагоциты способны осуществлять ряд других важных функций, таких как: ограничение роста облигатных внутриклеточных патогенов, продукция многих биоактивных молекул, необходимых для регуляции различных функций клеток (компоненты комплемента, простагландины и цитокины), удаление дефектных клеток.
Первичный ответ на внедрение микробного патогена в организм осуществляется резидентными макрофагами, которые продуцируют факторы воспаления и изменяют хемотаксический градиент. В свою очередь, нейтрофилы отвечают на межклеточные сигналы и проходят через эпителий, при этом их слабая адгезия опосредована - селектинами. Эти фагоциты уже активизированы для адгезии к эндотелию посредством собственных мембранных интегринов и способны распознавать специальными рецепторами - серпентинами - специфические хемоаттрактанты. Одновременно с этим происходит изменение формы клетки посредством перегруппировки активного цитоскелета. Нейтрофилы продолжают получать информацию, которая в дальнейшем изменяет их ответную реакцию.
Известны два отчетливо различимых функциональных состояния фагоцитов "redox", с низким уровнем протекания процессов, и активированное, который обусловлен взаимодействием клеток с различными стимуляторами. При этом в процессе предварительного воздействия стимулов отмечается усиление миграции, адгезии, дегрануляции и метаболизма нейтрофилов и макрофагов. Это явление получило название прайминга, то есть подготовки, перевода клеток в рабочее состояние. Таким образом, нейтрофилы, достигнув места воспаления, способны распознать патоген либо непосредственно через мембранные рецепторы для опсонинов, либо через лектины микробов и фагоцитов. В дальнейшем начинается процесс фагоцитоза, осуществляемый с помощью механизма, действующего как замок молния. Происходит поглощение микробов посредством инвагинации плазматической мембраны клеток и образование фагоцитарной вакуоли. При этом параллельно активируется две функции фагоцитов: выброс содержимого гранул в фагосому и кислородный взрыв.
Феномен кислородного взрыва впервые был описан в 1933 г., его суть состоит в том, что фагоциты резко увеличивают потребление кислорода - от 50 до 100 раз. Этот процесс происходит при стимуляции комплекса НАДФ - оксидазы, также известной как фагоцитарная оксидаза, или оксидаза кислородного взрыва. Субклеточная локализация этого комплекса хорошо изучена в нейтрофилах. В макрофагах этот комплекс выявляется только на плазматической мембране. Ввиду того, что составляющие этого комплекса, не обнаружены на мембранах гранул макрофагов - эти клетки не способны продуцировать реактивные виды кислорода внутрифагосомально.
На первом этапе для образования из молекулы кислорода супероксидного аниона О2 - донором электронов является НАДФ - оксидазный комплекс. Этот комплекс включает 4 белковых компонента, молекулярные массы, которых вошли в их название - Р40 PHOX (PHOX расшифровывается как фагоцитарная оксидаза. В клетках состояния покоя - “redox” - три этих компонентов - P40 PHOX,P47 PHOX и P67 PHOX находятся в цитозоле в виде комплекса, а два других компонента - P22 PHOX и gp91 PHOX локализованы на плазматической мембране или на мембране секреторных везикул и азурофильных гранул, где они представлены в виде гетеродимерных флавогемопротеинов, известных как цитохром b558. При стимуляции клеток цитозольный компонент р67 PHOXфосфорилируется и выступает в качестве адаптера связи компонента р67 PHOX с цитохрома b558, а в свою очередь, фосфорилирование р40 PHOX вызывает конформационные изменения р67 PHOX для его полноценной связи с цитохромом [9]. Таким образом, собранный НАДФ - оксидазный комплекс способен передаче электронов от субстрата к кислороду посредством собственных электрон-несущих протеазных групп - флавинов, преобразуясь при этом в так называемый восстановленный НАДФ+ - комплекс. В процессе сборки НАДФ-комплекса участвуют также низкомолекулярные белки, связанные с нуклеотидом гуаназин 5’ - трифосфатом - Rac. В процессе активации фагоцита Rac1/2 связываются с гуаназин фосфатом (ГТФ) и мигрируют к плазматической мембране вместе с основным цитозольным комплексом. В это же время цитохром b558 и Rap 1А доставляются к клеточной поверхности посредством слияния мембран, таким образом, локализуя НАДФ - оксидазный комплекс внутри фагосомы. Это позволяет эффективно доставлять активные метаболиты кислорода для уничтожения поглощенной мишени. Отмечаются различные пути регуляции НАДФ - оксидазы нейтрофилов в зависимости от того, где она локализована на плазматической мембране или на мембране гранул. Активация НАДФ - оксидазы, локализованы на плазматической мембране регулируется сложным путем комплекса сигналов, опосредованных через мощный приток Са2+. В моноцитах/макрофагах в процессе фосфорилирования принимает участие фермент - протеиновая киназа.
Продукт восстановления НАДФ - оксидазного комплекса супероксидный радикал - О2 - является начальным материалом для продукции обширного ряда реактивных оксидантов, включая окисленные галогены, свободные радикалы и синглетный кислород. Эти окислители используются для уничтожения поглощенных микроорганизмов, но они также вызывают множественное разрушение окружающих тканей, поэтому их формирование должно быть отрегулировано.
Второй этап - преобразование супероксидного аниона О2 в следующий мощный окислительный компонент перекись водорода (Н2О2) - может происходить спонтанно или катализироваться супероксиддисмутазой. Спонтанная реакция происходит при рН=4.8, при которой появляется равное количество О2 и Н2О. При повышенном значении рН и преобладании О2 падает показатель спонтанной дисмутации этого радикала и включается процесс катализации супероксиддисмутазой. Перекись водорода сама по себе не является бактерицидной. Подобный эффект отмечается только при ее высокой концентрации. Таким образом, экзогенно образованный супероксид и перекись водорода не способны на прямую убивать бактерии. Более мощным по бактерицидному воздействию являются другие реактивные метаболиты кислорода, образованные из перекиси водорода. В фагоцитах существуют 4 потенциальных механизма преобразования перекиси водорода. Первый путь осуществляется с помощью реакции Фентона, при участии сульфата железа. Ее результатом является гидроксильный радикал - ОН. К преобразованию трехвалентного железа в двухвалентное может подключаться супероксидный анион. Эта реакция получила названия супероксид - управляемой реакции или реакции Хабер-Вейса.
Содержание свободных ионов железа в клетках довольно низкое, и связанны с белками - миелопероксидазой, которая также может выступать в качестве катализатора при образовании перекиси водорода. Формирование гидроксильного радикала из НОCl и супероксида изолированными нейтрофилами зависит именно от наличия этого фермента. В настоящее время путь образования ОН с этим ферментом носит название "миелопероксидазно-Н2О2-хлоридная система".
Гидроксильные радикалы оказывают повреждающее действие на бактерии. Они способны, действуя на SH-группы, гистидиновые и другие аминокислотные составляющие белков, вызывать их денатурацию, таким образом, дезактивируя ферменты. Помимо этого в нуклеиновых кислотах ОН разрушает углеводные мостики между нуклеотидами и разрывает цепи ДНК и РНК, что может являться причиной мутации и гибели бактерий. Однако, по ряду причин эти радикалы не на столько эффективны в бактерицидности, как может предполагать их высокая реактивность. К ним относят ограниченное действие этих соединений из-за пространства фагосом, а также они могут прореагировать с другими субстратами, не достигнув бактерий. Тем не менее, было обнаружено, что гидроксильные радикалы, произведенные системами, включающими хлориды, наиболее токсичны для бактерий.
Синглетный кислород также продуцируется нейтрофилами при взаимодействии гидроксильного радикала с НОСl. При использовании ловушки для синглетного кислорода в нейтрофилах обнаружено высокое преобразование кислорода в синглетную форму при участии миелопероксидазно-Н2О2-хлоридной системы.
Недавно был назван ещё один реактивный метаболит кислорода - продукт респираторного взрыва в нейтрофилах: озон (О3). Озон сам по себе является бактерицидным, но в комбинации с перекисью водорода он ещё более токсичен для микроорганизмов.
В настоящее время, активно исследуется ещё один метаболит - оксид азота, присутствие которого отмечается и в фагоцитах. Оксид азота (NO) является свободным радикалом (газовой молекулой), который продуцируется из молекулярного кислорода и гуанидинового нитрогена L-аргинина, собранного в L-цитруллине. Было показано, что NO включается в неспецифический иммунитет и частично в комплексный механизм тканевого повреждения как важный медиатор воспалительных процессов и апоптоза. При этом цитотоксическое/ цитопатическое действие усиливается благодаря способности NO вступать в реакцию с супероксидным радикалом, образуя пероксинитрит.
Необходимо также упомянуть, что митохондриальное кислородное фосфорилирование занимает главное место в продукции реактивных видов кислорода как побочных продуктов электронной транспортной цепи. Количество митохондрий в различных типах клеток неравнозначно, и в фагоцитах оно не большое. В нейтрофилах почти весь потребляемый кислород минует малочисленные митохондрии и идет на образование оксидантов для осуществления прямой бактерицидной активности этих клеток. В макрофагах же имеется большее количество митохондрий, система которых гипертрофируется при активации клетки. В зрелых макрофагах место фермента миелопероксидазы существует другая альтернативная система разрушения Н2О2 и других активных форм кислорода, состоящая из каталазы и глутатионпероксидазы. Особенность альвеолярных макрофагов, которая и определяет их функциональную предназначенность как ключевых клеток воспаления, в том, что в процессе созревания из моноцита в макрофаг в этих фагоцитах отмечается резкое снижение внутриклеточного количества азурофильных гранул, которые включают основной арсенал бактерицидных ферментов: миелопероксидазу, сериновые протеазы, катионные белки и лактоферрин, характерные для нейтрофилов. Часто в литературе при описании включений фагоцитов отождествляют понятия "лизосомы" и "азурофильные гранулы". Эти две клеточные органеллы по своему содержанию отличаются друг от друга. Для азурофильных гранул характерно наличие биологически активных веществ, обладающих четко выраженным бактерицидным эффектом, то для лизосом - преимущественно содержание ферментов, участвующих в процессе переваривания поглощенных объектов. Эти кислые гидролазы и фосфатазы; при этом, как известно, кислая фосфатаза является специфическим маркером лизосом.
В результате исследований последних лет было установлено, что оксид азота, супероксиды и другие реактивные метаболиты кислорода участвуют во множестве физиологических и патологических процессов как сигнальные медиаторы - проводники. Временное регулирование преобразования различных источников реактивных метаболитов кислорода проходит путем модификации функции каскада сигнальной трансдукции. Если при высокой концентрации свободные радикалы кислорода и их производные являются опасными для живых организмов и могут избирательно разрушать определенные клетки, то при умеренной концентрации эти соединения могут играть важную роль в качестве регуляторных медиаторов в процессах сигнализации различных физиологических функций. К ним относятся: регуляция сосудистого тонуса, осуществление мониторинга в контроле кислородной вентиляции, в продукции эритропоэза и др.
Доказано, что оксид азота и реактивные метаболиты кислорода могут вызывать апоптоз различных типов клеток.
В настоящее время схема взаимодействия фагоцитов с патогенами в значительной степени была модифицирована:
Отмечается более длительный период жизни нейтрофилов, особенно при воспалениях и инфекциях.
Выявлены новые рецепторы, способные к распознаванию иммуномодуляторов.
Способность этих клеток к синтезу различных БАВ: цитокинов, таких как фактор некроза опухоли, интерлейкины, колониестимулирующие факторы, комплементарные белки, дефенсины и др.
Нейтрофилы могут регулировать экспрессию генов постоянно и индукционно. Уточняется роль этих фагоцитов в специфическом иммунном ответе. В частности, нейтрофилы способны кооперироваться с профессиональными антигенпредставляющими клетками через предобработку и протеолиз антигенов. При этом они могут вызывать экспрессию молекул класса II на мононуклеарных клетках, а также представлять антиген для вирусоспецифических Т-лимфоцитов памяти. Эти свойства проявляются параллельно с увеличением активности миелопероксидазно - Н2О2-хлоридной системы, чьи производные действуют как иммуномодуляторы, обеспечивая дальнейшую связь между первичным и адаптивным иммунитетом. Другой регулирующий аспект нейтрофилов включает продукцию и экзоцитоз различных факторов, которые модулируют функции лимфоцитов, моноцитов и эозинофилов.
Херст в 1956г. впервые описал антимикробные белки - фагоцитины, которые являются необработанной белковой фракцией полиморфноядерных лейкоцитов. Это положило начало исследованиям биологически активных белковых компонентов, которые нейтрофилы способны секретировать в очаге воспаления.
Особый интерес при исследовании белков цитоплазматических гранул нейтрофилов (их более 40) вызывают неферментные бактерицидные белки с низкой молекулярной массой, которые обладают суммарным положительным зарядом и бактерицидным действием. Эти протеины способны играть роль медиатора воспаления, фактора проницаемости, стимулятора метаболических процессов и служить источником не специфических опсонинов при фагоцитозе, модулируя свертывание крови и стимулируя адгезию, хемотаксис и зависимый от комплемента лизис. Данные белки являются специфическим маркером нейтрофилов. К группе этих белков относится: протеины, повышающие бактерицидные возможности клеток, кателицидины, которые содержаться в неактивной форме в азурофильных гранулах нейтрофилов, протеазы, способные утилизировать большую часть компонентов межклеточного матрикса и другие протеины. Все они могут вступать в роли физиологических медиаторов.
Следующая важная группа антимикробных пептидов, которую нельзя не упомянуть, это дефенсины, низкомолекулярные катионные белки, содержащие 6 цистеиновых и дисульфидных связей. И их деятельность направлена против грамотрицательных и грамположительных бактерий и осуществляется посредством нарушения целостности микробных мембран. Помимо бактерицидности, дефенсины проявляют свойства регуляторов воспалительного процесса, связываясь с ингибиторами протеазы.
Вывод:
Таким образом, исходя из вышеизложенного, можно сказать, что нейтрофилы обладают богатым потенциалом низкомолекулярных БАВ, которые они способны выделять во внеклеточное пространство. Определенное место занимают и молекулярные межклеточные медиаторы, выделяемые нейтрофилами-активные метаболиты оксида азота и кислорода. Эти межклеточные посредники фагоцитов способны контролировать развитие воспаления, как на ранней, так и на поздней стадии иммунного ответа организма, и такая взаиморегуляция функциональной активности этих клеток может вытекать из факта присутствия в организме их общей родоначальной клетки [6].
Активность фагоцитов характеризуется фагоцитарными показателями и опсонофагоцитарным индексом. Фагоцитарные показатели оцениваются числом бактерий, поглощенных или "переваренных" одним фагоцитом в единицу времени, а опсонофагоцитарный индекс представляет отношение фагоцитарных показателей, полученных с иммунной, т.е. содержащей опсонины, и неиммунной сыворотки. Эти показатели используются в клинической практике для определения иммунного статуса индивидуума. [3].