Реферат: Обезжелезивание природных вод
Подземные воды многих регионов земного шара часто характеризуются повышенным содержанием железа. Например, в Индокитае подземные воды с содержанием железа выше нормативов составляют около 60%. Железосодержащие воды широко распространены в Северной и Центральной Европе, в Сибири и на Дальнем Востоке, в Северной Америке, на Юге Африки.
Повышенное содержание железа в воде придает ей буроватую окраску, неприятный металлический привкус, вызывает зарастание водопроводных сетей и водоразборной арматуры, является причиной брака в текстильной, пищевой, бумажной, химической и других отраслях промышленности. Повышенное содержание железа в питьевой воде вредно для здоровья человека. При продолжительном введении в организм железа избыток его накапливается в печени в коллоидной форме оксида железа, получившей название гемосидерина, который вредно действует на клетки печени, вызывая их разрушение. Поэтому воду с повышенным содержанием железа необходимо обезжелезивать.
Многообразие форм и концентраций железа, встречающихся в природных и сточных водах, вызвало необходимость разработки целого ряда методов, технологических схем и сооружений обезжелезивания воды. Большой вклад в решение проблемы обезжелезивания природных и оборотных вод внесли российские ученые И.Э. Апельцин, В.А. Клячко, Г.И. Николадзе, Л.А. Кульский, А.М. Перлина, К.А. Мамонтов, Г.Ю. Асс.
В поверхностных водах железо обычно встречается в виде органических и минеральных комплексных соединений, либо коллоидных или тонкодисперсных взвесей. Преобладающей формой существования железа в подземных водах является бикарбонат железа (II), который устойчив только при наличии значительных количеств углекислоты и отсутствии растворенного кислорода. Наряду с этим железо встречается в видесульфида, карбоната и сульфата железа (II), комплексных соединений с гуматами и фульвокислотами.
Гидроксид железа может присутствовать в воде в коллоидном состоянии, которое является одной из основных форм существования. Оно в значительной степени повышается благодаря защитному действию гумусовых веществ в результате того, что частицы неустойчивого в воде (гидрофобного) коллоида адсорбируют на своей поверхности частицы другого коллоида, который имеет более сильную связь с молекулами воды, т. е. обладает гидрофильным характером. Железо может быть переведено ,из этого комплекса в осадок двумя путями: естественным — при участии бактерий, разрушающих органическое вещество, и искусственным — с помощью сильных окислителей, уничтожающих защитные коллоиды. Вместе с тем выпадению гидроксида железа из коллоидного состояния в осадок способствует наличие противоположно заряженных золей кремниевой кислоты (коагуляции).
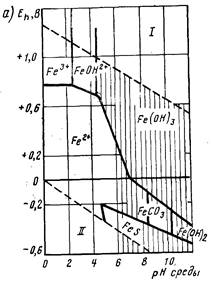
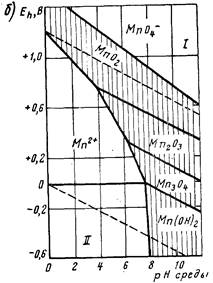
Рис. 1. Диаграммы Пурбе для железа (а) и марганца (б).
На рис. 1, а представлена диаграмма Пурбе, отражающая состояние системы железо — вода в координатах окислительно-восстановительный потенциал — значение рН. Вертикальными прямыми показаны значения рН гидратообразования при реально устанавливающемся равновесии в системе. Как следует из диаграммы, при значениях рН<4,5 железо находится в воде в виде ионов Fe3+, Fe2+ и Fe(OH)2+. Повышение значения рН приводит к окислению железа(II) в железо(III), которое выпадает в осадок. В этих же условиях при Е<0,2 В и наличии в воде сульфидов может выделяться черный осадок FeS. В восстановительной среде в присутствии карбонатов и при рН>8,4 возможно выделение карбоната, а при рН> 10,3 — гидроксида железа (II).
При наличии катализаторов — растворенных в обрабатываемой воде ионов меди, марганца и фосфат-ионов, а также при контакте ее с оксидами марганца или с ранее выпавшим гидроксидом железа(III) скорость окисления железа(II) кислородом значительно возрастает (рис. 2.2, а). С повышением значения рН среды время, затрачиваемое на окисление соединений железа (II), значительно сокращается. Окисление железа (И) кислородом воздуха происходит по реакции
4Fe2+ + 02 + 8НСО3- + 2Н2О = 4Fe(ОН)3 + 8С02
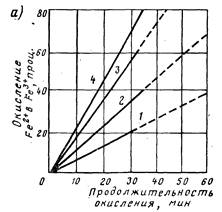
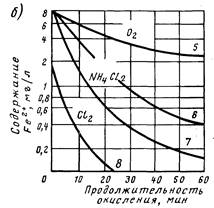
Рис. 2. Графики оксидации железа (И) кислородом в присутствии катализаторов (а) и кинетика его оксидации кислородом, хлорамином и хлором (б) при различных рН воды. 1 — без катализатора; 2, 3 — в присутствии меди и диоксида марганца (дозы по 0,02 мг/л); 4 — в присутствии гексаметафосфата (доза 2 мг/л);
По стехиометрии на окисление 1 мг железа (II) расходуется 0,143 мг растворенного в воде кислорода; щелочность воды при этом снижается на 0,036 мг-экв/л. Скорость окисления соединений железа(II) значительно возрастает при хлорирование воды (нормальный окислительно-восстановительный потенциал хлора Е=1,36 В). Соединения железа(II) в присутствии гидрокарбонатов природных вод полностью гидролизуют по реакции:
2Fe2+ + С12 + 6НСО3- = 2Fe(ОН)3 + 2Сl+ 6С02
По стехиометрии на окисление 1 мг железа (II) расходуется 0,64 мг хлора; щелочность воды при этом снижается на 0,018 мг-экв/л. Как видно из рис. 2.2, б, при замене свободного хлора дихлорамином (Е=0,66В при рН 5) время, необходимое для окисления соединений железа (II), значительно возрастает.
При обработке воды перманганатом калия реакция окисления и последующего гидролиза протекает по уравнению
4Fe2+ + МnО4- + 8НСО3- + 2Н20 = 4Fe(ОН)3 + МnО2 + 8С02
По стехиометрии на окисление 1 мг железа (II) расходуется 0,71 мг перманганата калия; щелочность воды при этом уменьшается на 0,036 мг-экв/л.
Для деферризации воды следует использовать несколько методов адекватно формам, количеству железа и буферным свойствам исходной воды. Все многообразие методов, применяемых в технологии обезжелезивания воды, можно свести к двум основным типам, реагентные и безреагентные. Из применяемых в настоящее время безреагентных методов обезжелезивания воды перспективными являются: вакуумно-эжекционная аэрация и фильтрование (рис. 2.3, а); упрощенная аэрация и фильтрование; «сухая фильтрация»; фильтрование на каркасных фильтрах; фильтрование в подземных условиях с предварительной подачей в пласт окисленной воды или воздуха (рис. 2.4); аэрация й двухступенчатое фильтрование; ультрафильтрация.
К реагентным относятся следующие методы: упрощенная аэрация, окисление, фильтрование, напорная флотация с известкованием и последующим фильтрованием; известкование, отстаивание в тонкослойном отстойнике и фильтрование-, фильтрование через модифицированную загрузку; электрокоагуляция, катионирование; озонирование и фильтрование.
Многообразие методов обезжелезивания воды исключает их равноценность в отношении надежности, технологичности, экономической целесообразности, простоты, области применения и т. п. Обезжелезивание поверхностных вод можно осуществить лишь реагентными методами, а для удаления железа из подземных вод наибольшее распространение получили безреагентные методы.
Безреагентные методы обезжелезивания могут быть применены, когда исходная вода характеризуется: рН — не менее 6,7; Щелочностью — не менее 1 мг-экв/л; перманганатная окисляемость — не более 7 мг 02/л. При этом при содержании железa(III) не более 10% от общего и концентрации железа(П) в бикарбонатной или карбонатной форме до 3 мг/л рекомендуется метод фильтрования на каркасных фильтрах без вспомогательных фильтрующих средств, до 5 мг/л предпочтительно применять метод сухой фильтрации от 5 до 10 мг/л следует использовать метод упрощенной аэрации с одноступенным фильтрованием; от 10 до 20 — аэрация и двухступенчатое фильтрование; от 10 до 30 мг/л — рекомендуется вакуумно-эжекционная аэрация с фильтрованием через загрузку большой грязеемкости.
При концентрации углекислого или карбонатного железа(П) более 20 мг/л или при содержании сероводорода 1...5 мг/л, рН 6,4 рекомендуется метод вакуумно-эжекционной аэрации с последующим отстаиванием в тонком слое воды или обработкой в слое взвешенного осадка и фильтрование.
Реагентные методы обезжелезивания воды следует применять при низких значениях рН, высокой окисляемости, нестабильности воды. При этом при содержании сернокислого или карбонатного железа, либо комплексных железоорганических соединений: до 10 мг/л и перманганатной окисляемости до 15 мг O2/л рекомендуется применять фильтрование через модифицированную загрузку, до 15 мг/л и перманганатной окисляемости до 15 мг 02/л предпочтителен метод, предусматривающий упрощенную аэрацию, обработку сильным окислителем и фильтрование через зернистую загрузку большой грязеемкости; свыше № мг/л и перманганатной окисляемости более 15 мг/л следует применять напорную флотацию с предварительным известкованием и последующим фильтрованием или метод, предусматривающий аэрацию, известкование, отстаивание в тонком слое и фильтрование; свыше 10 мг/л, перманганатной окисляемости более 15 мг 02/л при производительности установок до 200 м3/сут можно рекомендовать электрокоагуляцию с барботированием, отстаиванием в тонком слое и фильтрование.
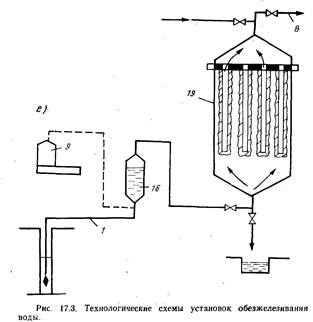
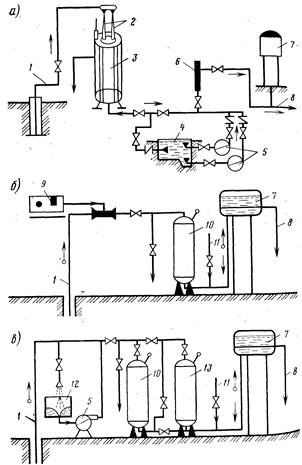
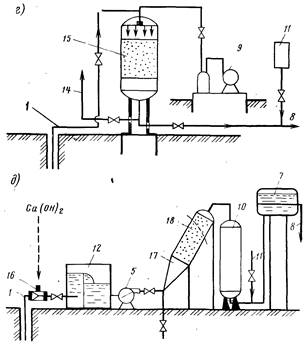
Рис. 2.3. Технологические схемы установок обезжелезивания воды.
а — вакуумно-эжекциоииой аэрации и фильтрования; б — упрощенной аэрации с одноступенчатым фильтрованием; в — упрощенной аэрации с двухступенчатым фильтрованием; г — сухой фильтрации; д — известкования; е — фильтрованием через намывной слой; 1 я 8— подача исходной и отвод обезжелезенной воды; 2 — вакуумно-эжекционный аппарат; 3 — каркасно-засыпные фильтры; 4 — резервуар промывной воды; 5 — повысительный насос; 6 и 11 — установка для фторирования и обеззараживания воды; 7 — водонапорный бак; 9 — воздуходувка; 10 — скорый осветлительный фильтр; 12 — аэрационное устройство; 13 — осветлительный фильтр II ступени; 14 — сброс воздуха; 15 — скорый фильтр с «сухой загрузкой»; 16 — смеситель; 17 — вихревая камера хлопьеобразования; 18 — тонкослойный отстойник; 19 — намывной фильтр
--> ЧИТАТЬ ПОЛНОСТЬЮ <--